Дихлорид - железо
Cтраница 2
Поскольку в реакционной зоне печи хлорирования температура практически достигает 650 - 750 С доля дихлорида железа, образующаяся за счет термического разложения трихлорида железа, незначительна. [16]
Тетрагидрат, FeQ2 - 4H20, выделяется в отсутствие воздуха ( в атмосфере С02) из насыщенного раствора дихлорида железа при температуре выше 12 3 ( соответственно при 30 - 40); представляет собой зеленовато-синие моноклинные кристаллы с плотностью 1 937 г / см3 и твердостью 2 по шкале Мооса. [17]
Образующаяся в процессе гидролиза хлора соляная кислота легко вступает во взаимодействие с железом, сопровождающееся образованием трихлорида железа РеС13 и дихлорида железа FeClz, которые хорошо растворимы в хлорной воде. Образование хлоридов железа протекает со значительной скоростью даже при температурах, заметно превышающих точку росы, поскольку хлориды железа являются гигроскопичными продуктами и конденсация влаги из газа идет и при этих температурах. [18]
Интересен также процесс регенерации соляной кислоты из отработанных травильных растворов, разработанный фирмой Пори ( США), в котором после упаривания отработанного раствора до концентрации 36 % РеСЦ проводят окисление дихлорида железа в трихлорид железа, а затем последний подвергают гидролизу при 176 С с получением F 2 3 и Процесс Пори в течение двух лет испытывался на опытной установке, а пуск промышленной установки производительностью 6780 л / ч в г. Кливленд ( шт. [19]
Реакция идет с заметной скоростью уже при 285 С, однако процесс рекомендуется проводить при 1000 С. Если выплавляемый дихлорид железа содержит следы металлического железа, его отделяют магнитом. Смесь РеС12 и VC12 образуется при обработке феррованадия хлористым водородом при 300 - 400 С. [20]
Более значительную коррозию металлов вызывают катионы высших степеней окисления, в том числе и их собственные. Например, железо корродирует в расплавах, содержащих дихлорид железа с образованием монохлорида, и особенно сильно, в присутствии трихлорида. На рис. 13.1 приведены результаты сравнения скорости коррозии циркония и железа в расплавах хлоридов щелочных и щелочно-земельных металлов в наиболее чистых условиях. [21]
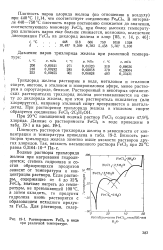 |
Растворимость FeCls в воде. [22] |
Трихлорид железа растворим в воде, метиловом и этиловом спирте, ацетоне, в этиловом и изопропиловом эфире, менее растворим в сероуглероде, бензоле. Растворенный в некоторых органических растворителях трихлорид железа восстанавливается на свету до дихлорида железа, при этом растворитель окисляется ( или хлорируется), например этиловый спирт превращается в ацеталь-дегид. [23]
При обработке горячекатаной полосы из углеродистой стали соляной кислотой находящаяся на поверхности окалина переходит в раствор. В результате после травления происходят снижение концентрации соляной кислоты и увеличение концентрации дихлорида железа. [24]
Каталитическое воздействие на равновесие реакции гидролиза хлора оказывают железо, соли никеля, хрома, марганца и некоторых других металлов. Железо взаимодействует химически с продуктами гидролиза хлора, образуя трихлорид железа FeCla и дихлорид железа FeCl2, хорошо растворимые в хлорной воде. Образование хлоридов железа и растворение их в хлорной воде являются основными причинами усиленной коррозии металлов в среде влажного хлора. Каталитическое воздействие солей никеля, хрома, марганца и некоторых других металлов состоит в резком ускорении реакции разложения хлорноватистой кислоты с образованием кислорода, что сдвигает равновесие реакции гидролиза хлора вправо. Интенсивное перемешивание газообразной и жидкой фаз при введении хлора в воду способствует ускорению процесса абсорбции газа и повышению концентрации С12 в воде. [25]
Безводный дихлорид железа получают из трихлорида железа восстановлением водородом. Исходное вещество ( РеС13) должно быть взято совершенно безводным, поэтому лучше получать дихлорид железа и трихлорид железа в одном и том же приборе. [26]
По другому методу дихлорид железа получают хлорированием металлического железа хлористым водородом. Если процесс вести при 700 С, продукт остается в реакционном пространстве, а при 850 - 1000 С дихлорид железа возгоняется и конденсируется в холодной части прибора. [27]
Для получения растворов хлорида железа используют стальную стружку и хлор. Часть готового раствора РеС13 восстанавливают с помощью стальной стружки до 32 % - ного раствора РеС12 и затем раствор дихлорида железа окисляют хлором до получения 35 - 45 % - ного раствора трихлорида железа. Растворы хлорида железа получают также улавливанием абгазного хлора отработанными травильными растворами или какими-либо другими растворами, содержащими FeClo. По патенту [64], промышленные отходы дихлорида железа концентрируют выпариванием с внешним подводом тепла и хлорируют, подавая испаренный хлор. [28]
Травление стали соляной кислотой получило широкое распространение, когда были разработаны технологические схемы, в которых процессы выделения и разложения хлорида железа были совмещены в одном аппарате. Из зарубежных публикаций известны пять вариантов осуществления этого процесса, отличающихся друг от друга в основном типом реактора для окисления дихлорида железа. Основной принцип процесса для всех вариантов является общим. Он заключается в следующем. Травильный раствор, подлежащий регенерации, распыляется в реакторе при температуре 500 - 800 С. При этих условиях и в присутствии кислорода воздуха происходят испарение воды и разложение дихлорида железа на оксид железа и хлорид водорода. Образующийся оксид железа осаждается или в самом реакторе или в последующем пылеотделителе и извлекается как побочный продукт. Из газовой смеси, содержащей хлорид водорода, пары воды и газообразные продукты горения, хлорид водорода выделяют поглощением водой и в виде соляной кислоты возвращают на травление. Как уже сказано выше, в зависимости от типа реактора для окисления дихлорида железа установки делятся на пять вариантов. [29]
Замещение железа хромом при взаимодействии хлоридов железа с феррохромом зависит от температуры. До 800 К более вероятно замещение железа на хром в трихлориде железа, а в интервале 800 - 1300 К - замещение железа на хром в дихлориде железа. При хлорировании феррохрома в вертикальном хлораторе соотношение образующихся хлоридов двух - и трехвалентного хрома зависит от расхода и скорости подачи хлора, высоты слоя феррохрома и температуры. [30]
Страницы: 1 2 3