Дихроматы
Cтраница 1
Дихроматы ( бихроматы) - соли двухромной кислоты, содержат дихромат ( бихро-мат) - ион СггО; напр. [1]
Дихроматы Na2Cr2O7 - 2H2O и К2Сг2О7 называются х р о м п и-к а м и. Они как окислители применяются в кожевенной ( дубление кож), лакокрасочной, спичечной и текстильной промышленности. Хромовая смесь - так называется 3 % - ный раствор дихромата калия в концентрированной серной кислоте - применяется в химических лабораториях для мытья стеклянной посуды. [2]
Дихроматы применяются в лабораторной практике как окислители. Во всех окислительно-восстановительных реакциях трехвалентный хром окисляется до шестивалентного, а шестивалентный восстанавливается всегда до трехвалентного. Дихромат аммония при нагревании разлагается. [3]
Дихроматы Na2Cr2O7 - 2H2O и К2Сг2О7 называются хромп и-к а м и. Они как окислители применяются в кожевенной ( дубление кож), лакокрасочной, спичечной и текстильной промышленности. Хромовая смесь - так называется 3 % - ный раствор дихромата калия в концентрированной серной кислоте - применяется в химических лабораториях для мытья стеклянной посуды. [4]
Двойные дихроматы висмута состава MBi ( Cr2O7) 2, где М Ag, К, Tl, NH4, Rb получены из водного раствора при взаимодействии В1 ( МОз) з, N CraO. Монокристаллы AgBi ( Cr2O7) 2 и МЬЦВ С О / Ъ образуются из водного раствора при 4 С, а KBi ( Cr2O7) 2, TlBi ( Cr2O7) 2 и RbBi ( Cr2O7) 2 при 50 С. AgBi ( Cr2O7) 2 кристаллизуется в тетрагональной сингонии с параметрами решетки а 8 4944, с 8 1313 А, Ризм 4 23, рвыч 4 238 г-см-3, Z2, пр. [5]
Хроматы и дихроматы в кислой среде являются сильными окислителями. [6]
Хроматы и дихроматы - сильные окислители, особенно если реакции идут в кислой среде. [7]
Хроматы и дихроматы легко переходят друг в друга в зависимости от рН раствора. [8]
Хроматы и дихроматы как соли хромовых кислот обладают, особенно в кислой среде, сильными окислительными свойствами. [9]
Хроматы и дихроматы легко переходят друг в друга в зависимости от рН раствора. [10]
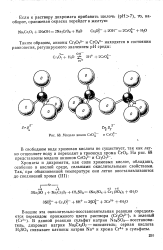 |
Модели ионов СгО и СгО7. [11] |
Хроматы и дихроматы, как соли хромовых кислот, обладают, особенно в кислой среде, сильными окислительными свойствами. [12]
Практически все дихроматы хорошо растворимы в воде, хроматы же, наоборот, как правило, малорастворимы, за исключением хро-матов щелочных металлов и аммония. [13]
Хромоты и дихроматы щелочных металлов - натриевые или калиевые соли хромовой Н2СгО4 или бихромовой HjC O; кислоты. Это порошки желтого ( хроматы) и оранжевого ( бихроматы) цвета, хорошо растворимые в воде. Поставляются заводами-изготовителями в железных барабанах массой 130 - 220 кг. [14]
Все хроматы и дихроматы - сильные окислители, особенно если реакции протекают в кислой среде. [15]
Страницы: 1 2 3 4