Диэтилбериллий
Cтраница 2
С хлористым водородом при температуре жидкого воздуха диэтилбериллий реагирует с образованием хлористого бериллия, но реакция не проходит до конца, так как получающийся хлористый бериллий обволакивает частицы диэтилбериллия, препятствуя дальнейшей реакции. [16]
С хлористым водородом при температуре жидкого воздуха диэтилбериллий реагирует с образованием хлористого бериллия, но реакция не проходит до конца, так как получающийся хлористый бериллий обволакивает частицы диэтилбериллия, препятствуя дальнейшей реакции. [17]
При полимеризация пропилена на системах ct - TiCl3 - Be ( C2H5) 2 и a - TiCl3 - А1 ( С2Н5) з - Zn ( C2H5) 2 присоединение первого мономерного звена к каталитическому центру Кат - C2Hs, образовавшемуся после реакций оргаяичения цепи диэтилбериллием и диэтилц ия-ком, происходит так же быстро, как и присоединение последующих мономерных звеньев. [18]
Алкоголиз диалкилбериллиев также протекает весьма бурно. Метиловый и изопропиловый спирты реагируют с диэтилбериллием при - 80 С весьма энергично; реакция с этиловым спиртом протекает более спокойно. [19]
Алкоголиз диалкилбериллиев также протекает весьма бурно. Метиловый и изопропиловый спирты реагируют с диэтилбериллием при - 80 С весьма энергично; реакция с этиловым спиртом протекает более спокойно. [20]
Попытка использования карбонилов и алкилов металлов в реакции с бис ( р-дикетонами) оказалась неудачной [37]: карбонил никеля и бис ( трифенилфосфин) никель не реагируют с тетракето-нами. Не было достигнуто положительных результатов и при использовании в качестве исходных веществ диэтилбериллия и три-изобутилалюминия. [21]
В работе итальянских исследователей [ 161 среди других ме-талл Ъорганических соединений разделена смесь диэтилиинка и три-этилбора при 73 С. Однако при этом пик, соответствующий ди-этилцинку, выходит в размытой форме. Кроме того, были разделены ппи 143 С диэтилбериллий и триэтилалюминий. [22]
По-видимому, первым упоминанием об образовании бериллийоргани-ческих соединений следует считать наблюдение Каура [2] о реакции бериллия с йодистым этилом при нагревании в запаянной трубке. В этих условиях образовался твердый продукт, который при перегонке дал жидкость, энергично разлагающуюся водой с выделением воспламеняющегося газа. Франкланд [3] в своем обзоре указывает на аналогию между этой реакцией и действием аллюминия на йодистый этил, подчеркивая, однако, что образование диэтилбериллия не было подтверждено анализом. [23]
Дифенилбериллий и ди - / г-толилбериллий - кристаллические вещества, растворимые в бензоле и эфире, вероятно, несколько ассоциированные. Ди-н-про илбериллий и ди-н-бутилбериллий представляют собой жидкости. Первый, как сообщалось [58], перегоняется при 244 - 246 при атмосферном давлении; весьма вероятно, что при этой температуре он несколько разлагается, хотя он должен быть более устойчив, чем диэтилбериллий. Ди-грег-бутилбериллий известен только в виде эфирата. [24]
Для синтеза аморфных полимеров методом чередующейся сополимеризации рекомендуется брать растворимые или псевдорастворимые катализаторы, которые менее пригодны для полимеризации пропилена и высших а-олефинов. С помощью этих катализаторов часто удается получить полностью растворимые полимеры. Для этой цели в качестве компонента каталитической системы рекомендуются растворимые соединения элементов IV-VIII групп периодической системы, например алкилортованадаты или ацетилаиетонаты титана или хрома. Их смешивают с соединениями элементов I-III групп, например диэтилбериллием, триизобутил-алюминием или диэтилалюминийхлоридом. [25]
В соответствии с патентом [100] катализатор нагревают в автоклаве и затем подают туда этилен. При температурах 200 - 225 двойные связи смещаются к центру молекулы. С увеличением давления продолжительность реакции уменьшается, а молекулярный вес продукта возрастает. Оптимальные условия для получения полиэтилена с молекулярным весом в пределах 10000 - 30000, по-видимому, таковы: температура 60 - 160, давление до 2000 ат и примерно 0 1 % ( или менее) активатора - триэтилалюминия или диэтилбериллия. [26]
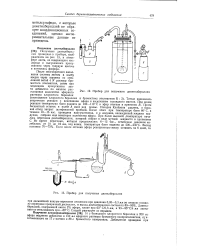 |
Прибор для получения диметилбериллия.| Прибор для получения диэтилбериллия. [27] |
Под конец реакции температура бани поднята до 100 - 110 С и эфир отогнан в приемник В. Насадка Кляйзена удалена, и боковой отвод закрыт шлифованной пробкой. После этого при температуре бани 80 С-в течение 10 - 15 час. При более высокой температуре началась перегонка диэтилбериллия, который собран в виде мутной жидкости в приемнике С. Во время перегонки, которая продолжалась 6 - 12 час. [28]
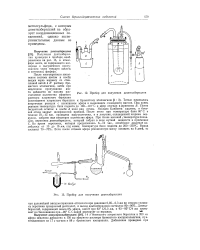 |
Прибор для получения диметилбериллия.| Прибор для получения диэтилбериллия. [29] |
Под конец реакции температура бани поднята до 100 - 110 С и эфир отогнан в приемник В. Насадка Кляйзена удалена, и боковой отвод закрыт шлифованной пробкой. После этого при температуре бани 80 С в течение 10 - 15 час. При более высокой температуре нача-лась перегонка диэтилбериллия, который собран в виде мутной жидкости в приемнике С. Во время перегонки, которая продолжалась 6 - 12 час. [30]
Страницы: 1 2