А-окисление
Cтраница 1
Механизм а-окисления детально изучили при использовании в качестве субстрата 3-индолилацетонитрила. Этот нитрил был выбран благодаря легкости определения возможных промежуточных продуктов егоа-окисления. [1]
Значение а-окисления в растениях неясно. Исследование митохондрий арахиса показывает, что скорости окисления 1 - С14 - пальми-тиновой кислоты при Р - и а-окислении приблизительно равны. Окисление энергетически совсем не столь продуктивно, как р-окисление. При каждом обороте цикла а-окисления образуется 1 молекула восстановленного НАД. Окисление одной молекулы восстановленного НАД в дыхательной цепи дает три молекулы АТФ. Таким образом, отщепление каждого двууглеродного фрагмента при а-окислении приводит к образованию только 6 молекул АТФ по сравнению с 16 молекулами, которые получаются в результате отщепления каждого двууглеродного фрагмента при сочетании р-окисления и цикла Кребса. Кроме того, а-окисление может претерпевать только ограниченное число высокомолекулярных жирных кислот. [2]
При а-окислении алкильная цепь прогрессивно укорачивается на один атом углерода, который выделяется в виде СОа-В-Окисление ведет к последовательному уменьшению алкильнои цепи на два атома углерода сразу. [3]
Расщеплению посредством а-окисления подвергаются только высокомолекулярные жирные кислоты. Лауриновая кислота и низкомолекулярные жирные кислоты являются неактивными субстратами а-окисления. [4]
Жирные кислоты, а-окисление - второстепенный путь окисления жирных кислот, осуществляющийся с карбоксильного конца и а-атома углерода. [5]
В то время как а-окисление в процессах распада жирных кислот, вероятно, играет весьма ограниченную роль, реакции р-окисления являются, по-видимому, основным путем распада жирных кислот в тканях растений. [6]
Таким образом, процесс а-окисления жирных кислот является двустадийным, Полного окисления жирных кислот до СО2 и НаО по ос-механизму не происходит, так как пероксидазой жирных кислот используются в качестве субстрата молекулы с 13 - 18 атомами углерода. [7]
По данному механизму в результате а-окисления гидроксилируются, в частности, боковые цепи барбитуратов. [8]
В литературе уже отмечалось4, что а-окисление кетонов хотя само по себе и не вызывает сомнений, вместе с тем не объясняет ряда экспериментальных данных и что, по-видимому, распад а-кетогидролерекиси, считающейся основной стадией образования кислот, является только одной из многих. [9]
При этом всегда выход снижается из-за побочной реакции а-окисления промежуточно образовавшегося альдегида, которая приводит к распаду молекулы путем разрыва связи С - С ( см. разд. [10]
Как видно из схемы, кислота сначала подвергается а-окислению, затем последовательно - декарбоксилированию и декарбонилированию. [11]
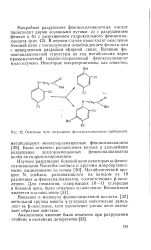 |
Основные пути деградации феноксиалканоатных гербицидов. [12] |
Для гомологов, содержащих 10 - 11 углеродов в боковой цепи, было отмечено а-окисление. [13]
 |
Продукты окисления 2 4-дихлорфеноксиалкилнитрилов тканями пшеницы. [14] |
Кроме этих продуктов, небольшие количества соединений образуются по пути 2, причем их образование лучше всего можно объяснить а-окислением нитрилов до соответствующей кислоты с меньшим на один числом углеродных атомов. [15]
Страницы: 1 2