А-орбита
Cтраница 1
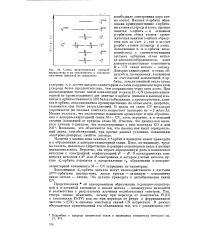 |
Схема энергетических уровней цианид-иона и их заселенность в основном состоянии ( масштаб не выдержан. [1] |
Низшая а-орбита образована преимущественно s - орбита-ми атомов углерода и азота, высшая занятая с-орбита - в основном р-орбитами обоих атомов; промежуточная занятая с-орбита образуется как за счет s -, так и за счет р-орбит атомов углерода и азота. Заполненные а - и я-орбиты, взаимодействуя с соответствующими пустыми орбитами атома метал-ла-комплексообразователя, дают донорно-акцепторные компоненты М - CN связи металл - лиганд. [2]
Три занятые а-орбиты соответствуют двум парам электронов ( одна из которых преимущественно локализована около атома азота, а вторая - около атома углерода) и одной а-связи между атомами углерода и азота. Дважды вырожденная лс: в-орбита соответствует образованию двух я-свя-зей. [3]
Три а-орбиты, направленные к центру, образуют трехцентровые молекулярные орбиты. [4]
 |
Октаэдрпческие п тетраэдрпческие местоположения.| Расщепление й-орбит в октаэдри-ческом ( а и тетраэдрическом ( б полях. [5] |
Стрелками указана ориентация а-орбит. [6]
 |
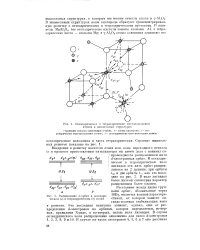
Схемы молекулярных орбит в сопряженных циклах СЬН5, СвН и С Н.| Расщепление D-терма электронной конфигурации d1 в поле октаэдрической и тетраэдрической симметрии. [7] |
Аналогично можно ввести молекулярную а-орбиту. Такие орбиты особенно наглядны для плоских систем с сопряжением. Так, для молекулы бензола все ориентированные перпендикулярно плоскости молекулы рл-орбиты атомов углерода участвуют в образовании единой сопряженной системы молекулярных я-орбит, электронное облако к-рых симметрично относительно плоскости молекулы и, следовательно, в области, между соседними атомами углерода имеют вид облака я-связей. В таких молекулах ег-связи между атомами обычно предполагают локализованными валентными, образованными sp2 гибридными орбитами углерода. Нередки случаи, когда одна и та же МО системы для одной пары атомов является а-орбитой, а для другой я-орбитой. В этом случае МО является смешанной а-я-орбитой. [8]
Утверждают, что перекрывание а-орбиты связи R - - В одной молекулы вакантной р-орбитой атома бора другой молекулы не может произойти из-за малой доступности вакантной орбиты, что обусловлено смещением электронов от галоида к бору. Но такое объяснение слишком упрощенное. Имеется очень мало или даже вовсе нет прямых указаний на то, что смещение электронов от галоида к бору заметно ослабляет электрофильные свойства бора. [9]
В образовании чистых о-молекулярных орбит комплекса могут участвовать а-орбиты цианид-иона, дважды вырожденные ( типа eg) орбиты 3d, , Зс и металла и 4з - орбиты ( типа talg) металла. В результате возникают шесть связывающих и шесть разрыхляющих молекулярных орбит комплекса. [10]
Малликен в этой работе ввел следующую символику: связевые а-орбиты углеродного атома он обозначает символами te ( тетраэдрическая), tr ( три-гональная) и di ( дигональная), а электроны символами, смысл которых поясним на следующем примере. [11]
 |
Схема образования молекулярных орбит. [12] |
Молекулярные орбиты, обладающие цилиндрической симметрией относительно оси молекулы, называют а-орбитами. При комбинации двух ри или рг орбит отсутствует симметрия относительно направления связи межд двумя атомами. [13]
Так, d2sp3 - op & HTbi центрального атома перекрываются с линейной комбинацией а-орбит аддендов ( групповыми орбитами) с образованием or - связей. Перекрывалие dxy -, dyz - и - орбит центрального иона с орбитами адденда приводит к я-связям. В результате взаимодействия каждой пары орбит названных типов образуются две новых молекулярных орбиты, одна из которых более ( связывающая орбита), а другая менее ( разрыхляющая орбита) устойчива по сравнению с любой из исходных взаимодействующих орбит. Орбиты, электронное состояние которых не изменяется в результате образования связи по сравнению со свободным ионом называются несвязывающими. В случае октаэдрического комплекса возможно шесть связывающих и шесть разрыхляющих орбит. [14]
CN ( jaa счет электронов высшей занятой о - орбиты иона CN -) две заполненные а-орбиты - низшая и высшая ( особенно последняя) и заполненные it - орбиты становятся более стабильными, а промежуточная о - орбита дестабилизируется. При этом в целом связь CN несколько упрочняется. [15]
Страницы: 1 2 3