Ковалентная а-связь
Cтраница 1
Ковалентная а-связь возникает при перекрывании вакантной орбитали атома металла с заполненными орбиталями донорной группы. Донорная группа должна поэтому содержать по крайней мере одну неподеленную пару электронов. Видно, что эта связь, называемая координационной, подобна ковалентной связи, образованной перекрыванием двух орбиталей. Однако она может обладать значительной полярностью в зависимости от способа образования. [1]
Ковалентная а-связь возникает при перекрывании вакантной орбитали атома металла с заполненными орбиталями донорной группы. Донорная группа должна поэтому содержать, по крайней мере, одну неразделенную пару электронов. Видно, что эта связь, называемая координационной, подобна ковалентной связи, образованной перекрыванием двух орбиталей. Однако она может обладать значительной полярностью в зависимости от способа ее образования. [2]
Ковалентная а-связь возникает при перекрывании вакантной орбитали атома металла с заполненными орбиталями донорной группы. Донорная группа должна поэтому содержать по крайней мере одну неподеленную пару электронов. Орбиталь атома металла является гибридной, сформированной из подходящих S -, р - и d - орбиталей. Эта связь, называемая координационной, подобна ковалентной связи, образованной перекрыванием двух направленных орбиталей. Конечно, она может обладать значительной полярностью в зависимости от способа образования. [3]
В этом случае связи металл - углерод являются ковалентными а-связями. В результате этого порядок связи углерод - кислород уменьшается и эта связь становится аналогичной связи в органических карбонилах. Кейбл и Шеляйн ( 1956) сравнили мости-ковые карбонилы металлов с циклобутаноном. [4]
По теории поля лигандов сила этого поля коррелирует с прочностью ковалентных а-связей металл-лиганд. Поле лигандов в соединениях металлов часто характеризуют энергией электронного перехода Л между уровнями симметрии. Слабое поле ( малое значение А), как правило, обусловлено слабыми химическими связями лигандов с металлом. В случае же лигандов с большими значениями Д наблюдается склонность к образованию спин-спаренных комплексов, приближающихся к соединениям ковалентного типа. [5]
Электронное строение органических соединений возникает в результате образования химических связей нескольких типов: ковалентной а-связи, ко-валентной тс-связи, сопряженной тс тс - и и тс-связи, ароматической тс-связи, донорно-акцепторной ( координационной) с - или тс-связи, включая водородную связь. Эти МО могут быть локализованными ( закрепленными) между двумя атомами или же делокализованными между тремя или большим числом атомов. [6]
Затем два электрона из шести я-электронов цикла локализуются у одного атома углерода и участвуют в образовании новой ковалентной а-связи с вступающим заместителем, а остальные четыре электрона распределяются между пятью атомами углерода цикла. [7]
Далее рассмотрим совокупность поверхностей для реакции двух радикалов, в ходе которой образуется молекула, связанная ковалентной а-связью или ионной связью. Такими случаями являются мономолекулярные сольволитические реакции. [8]
Для ртути ( П) характерно образование ртутьорганических соединений, в которых атом ртути соединен с органическим радикалом посредством ковалентной а-связи Hg - С. [9]
Вторая стадия - взаимодействие катиона нитрония с я-электронным облаком ароматического ядра с образованием я-комплекса, затем два электрона из шести л-электронов локализуются у одного атома углерода и участвуют в образовании новой ковалентной а-связи с вступающим заместителем, а остальные четыре электрона распределяются между пятью атомами углерода. Так образуется промежуточный карбкатион, в котором нарушена ароматичность, так называемый сг-комплекс. Нарушение ароматического состояния невыгодно, поскольку ароматическое ядро обладает большой устойчивостью. Поэтому происходит быстрая потеря протона, а ароматичность восстанавливается. [10]
Согласно современным представлениям, электронная плотность в молекулах каждого вещества распределена вполне определенным образом в соответствии с химическим строением. Каждой простой ковалентной а-связи соответствует орбита ( облако) пары электронов, осуществляющих эту связь. Распределение электронной плотности 0-связи симметрично относительно оси, проходящей через центры связанных атомов. [11]
Согласно современным представлениям, электронная плотность в молекулах каждого вещества распределена вполне определенным образом в соответствии с химическим строением. Каждой простой ковалентной а-связи соответствует орбита ( облако) пары электронов, осуществляющих эту связь. Распределение электронной плотности а-связи симметрично относительно оси, проходящей через центры связанных атомов. [12]
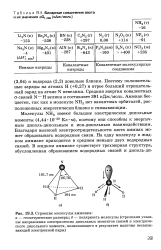 |
Бинарные соединения азота и их значения ДО, 29В ( кДж / моль.| Строение молекулы аммиака. [13] |
Поэтому положительные заряды на атомах Н ( 0 27) и втрое больший отрицательный заряд на атоме N невелики. Средняя энергия ковалентных а-связей N - Н велика и составляет 391 кДж / моль. Аммиак бесцветен, так как в молекуле NH3 нет вакантных орбиталей, расположенных энергетически близко к связывающим. [14]
Двойная связь осуществляется двумя парами электронов, принадлежащими связываемым углеродным атомам. Одна пара электронов при этом образует обычную ковалентную а-связь, вторая пара - л-связь. [15]
Страницы: 1 2