Простая а-связь
Cтраница 2
Способность литийорганических соединений образовывать ассоциаты и комплексы обусловлена характером связей литий-углерод. Простая а-связь реализуется, по видимому, в мономерных соединениях лития, трехцентровая - в димерах. Четырехцентровая связь реализуется, вероятно, в тетрамерах. Рентгеноструктурные исследования показали, что тетрамеры имеют тетраэдр ическую структуру, причем атомы лития находятся в вершинах тетраэдра, а алкильные группы - над центром каждой из его граней. [16]
Молекулы органических соединений могут иметь различное распределение электронной плотности. В простых а-связях электронная плотность распределена симметрично относительно оси, проходящей через оба центра образующих ее атомов. Молекулы симметрично построенных органических соединений имеют и симметричное распределение электронной плотности. [17]
В случае простой а-связи расщепления молекулярных сроит можно дооиться простой пеоегибпиттиза-цней углеродных атомных функций ( АО), строящихся из s - и р-функшш. [18]
В ходе разработки этой проблемы Хюккель, а также Полинг и Уэланд исходили из допущения, что для образования молекулярной группы из шести я-электронов каждый углеродный атом в бензоле предоставляет один атомный р-электрон с осью симметрии, перпендикулярной плоскости молекулы. Остальные электроны участвуют в образовании простых а-связей, составляющих правильный шестиугольник из шести СН-центров. Предполагают, что каждый я-электрон движется в общем потенциальном поле шестиугольного каркаса и в выравненном поле остальных я-электронов. [19]
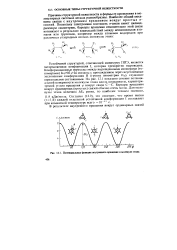 |
Потенциальная функция внутреннего вращения в молекуле этана. [20] |
Причины структурной нежесткости и формы ее проявления в молекулярных системах весьма разнообразны. Наиболее общий механизм связан с внутренним вращением вокруг простых а-связей. [21]
Одна из заполненных d - орбиталей металла перекрывается с одной пустой d - орбиталью атома фосфора, вследствие чего возникает йя - я-связь. Возможно, что эта связь даже сильнее, чем простая а-связь. Интересно отметить, что такая картина подтверждается тем фактом, что при увеличении электроотрицательности Х - групп, связанных с атомом фосфора, прочность связи металл - лиганд увеличивается. Это может быть предсказано, так как сдвиг электронной плотности к атому фосфора делает его бол ее восприимчивым к электронам, отдаваемым атомом металла. Конечно, усиление а-связи при сближении атомов также должно давать определенный вклад в силу связи. Однако относительная величина этого фактора пока еще не определена. [22]
Одна из заполненных d - орбиталей металла перекрывается с одной пустой d - орбиталью атома фосфора, вследствие чего возникает dn - ил-связь. Возможно, что эта связь даже сильнее, чем простая а-связь. Интересно отметить, что такая картина подтверждается тем фактом, что при увеличении электроотрицательности Х - групп. Это может быть предсказано, так как сдвиг электронной плотности к атому фосфора делает его более восприимчивым к электронам, отдаваемым атомом металла. Конечно, усиление ст-связи при сближении атомов также должно давать определенный вклад в силу связи. Однако относительная величина этого фактора пока еще не определена. [23]
Из них 12 электронов используются для образования шести простых связей С - Н и 12-для образования шести простых а-связей С-С. Остаются еще шесть электронов и шесть неиспользованных в а-связях р-орбиталей атомов углерода. Возможно, эти орбитали используются попарно для образования еще трех ковалентных связей. [24]
Центральный атом азота отдает один электрон третьему атому азота, не связанному с. Поэтому все атомы азота расположены по прямой, между ними возникают двойные связи, а между азотом 1 и водородом - простая а-связь. В отличие от него атом азота 3, помимо электровалентности проявляет ковалентность, равную двум. Тогда отпадает необходимость привлечения формальной концепции об электровалентности. [25]
Существует глубокая аналогия между солюбилизацией углеводородов в мицеллах и атермическим набуханием вы-сокополимеров. Углеводородные цепи ПАВ в некотором смысле могут проявлять свойства высокополимеров, поскольку их длина намного превышает площадь поперечного сечения, и единственным способом изменения конфигурации цепей является поворот вокруг простой а-связи, как и в высоко полимер ах. [26]
Эти конформаций были названы Мулликеном ( 1939 г.) s - цис - и - яг оанс-конформациями. Буква я указывает, что изомерия возникла у простой а-связи. [27]
Лучше понять особенность химической связи в резонансных системах позволяет рассмотрение образования в них а - и я-связей. Резонанс может возникать в тех случаях, когда я-связь охватывает больше двух атомных ядер. Например, в молекуле SO 2 три атома связаны друг с другом простыми а-связями. [28]
В молекуле ацетилена, С2Н2, к каждому атому углерода присоединено всего по одному атому водорода. У каждого атома углерода s - орбиталь и одна из трех его р-орбиталей гибридизуются с образованием двух sp - орбиталей, ориентированных под углом друг к другу. Одна из sp - орбиталей используется для образования а-связи с атомами водорода, а другая-для образования простой а-связи С-С. На каждом атоме углерода остается еще по две негибридизованные 2р - ор-битали. [29]
В этой молекуле с открытой цепью эффекты сопряжения играют небольшую роль. Длина связи С2 - С3 в бутадиене равна лишь 1 483 А по сравнению со связью С-С в пропане, длина которой составляет 1 526 А. В настоящее время известно, что такое уменьшение длины связи вызвано в основном гибридизацией, не тем, что эта связь имеет частично характер двойной связи. Связь Сз-Сз в бутадиене - по существу простая а-связь, но образованная вследствие перекрывания гибридных s / Я-орбиталей. [30]
Страницы: 1 2