Одинарная а-связь
Cтраница 1
Одинарная а-связь допускает свободное вращение связанных атомов и групп атомов, поэтому вследствие теплового движения молекулы меняют свою форму. Неидентичные состояния, через которые проходят эти молекулы в процессе свободного вращения, называют конфор-мациями. Молекулы, находящиеся в различных конформационных состояниях, имеют различную энергию. Иногда существует несколько устойчивых конформационных состояний. [1]
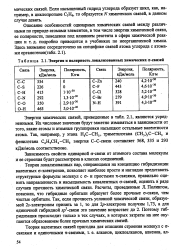 |
Энергия и полярность локализованных химических а-связей. [2] |
Зависимость свойств одинарной а-связи от атомного состава молекулы и ее строения будет рассмотрена в классах соединений. [3]
Молекула Li2 имеет таким образом одинарную а-связь. [4]
Углеводороды, в молекуле которых помимо одинарных а-связей углерод - углерод и углерод-водород имеются углерод-углеродные я-связи ( см, гл. [5]
Исходя из этого, можно предположить, что средняя одинарная а-связь С-С приближается по своей природе к двойной связи. Ti-Связи расположены в плоскости, перпендикулярной той, в которой расположены все атомы молекулы. [6]
Анализ межатомньих расстояний в молекуле индиго показывает отсутствие одинарных а-связей ( за исключением связей с атомами водорода) и классических двойных связей. Связи являются промежуточными между ординарными и двойными не только в бензольных циклах, но и в гетероциклах молекулы. [7]
Чем определяется величина угла, образованного двумя ковалентнымж одинарными а-связями при атоме кислорода. [8]
Насыщение кратных связей, как правило, требует менее отрицательного потенциала, нежели разрыв одинарной а-связи, так как энергия низшей вакантной орбиты для it - связи значительно ниже, чем для G-СВЯЗИ. Однако уже упоминался ряд примеров, где разрыв связи С - X под влиянием активирующих заместителей Ъ я-связями происходит при более положительных потенциалах. Сюда следует еще добавить восстановление полигалоиднитроалканов [28] и гем-полинитросоединений [29], в которых разрыв связи С - Г или С - NO2 имеет место до потенциалов восстановления нитрогруппы. Указанные механизмы в простом виде приложимы в случаях, когда полярографически активная группа связана с насыщенным алифатическим или ароматическим радикалом, но не сопряжена с другой полярографически активной группой. Только изолированные группы сохраняют свою полярографическую индивидуальность. [9]
Так как энергия двойной ( этиленовой) связи 101 2 ккал / молъ, энергия одинарной а-связи ( С-С) - 62 5 ккал / моль, то энергия тс-связи С-С равна ( 101 2 - 62 5) 38 7 ккал / молъ; я-связь значительно слабее а-связи. [10]
Меньшая эффективность обмена при угле мостика Fe-О - Fe, равном 90, объясняется тем, что спиновый момент может передаваться только через одинарную а-связь Fe - О, тогда как передача спинового момента через я-перекрываю-щиеся орбитали в данном случае малоэффективна. [11]
Если два атома углерода с тетраэдрическими ( гибридными) орбита-лями сближаются по линии, являющейся биссектрисой угла, образованного направлениями осей двух орбиталей, то происходит перекрывание двух пар орбиталей, как это показано на фиг. Это перекрывание, конечно, не столь велико, как для двух одинарных а-связей, тем не менее оно достаточно для образования связи, более прочной, чем простая связь. [12]
Другие примеры можно найти среди молекул с внутренним вращением, когда одна часть молекулы может разворачиваться относительно другой на большие углы. Обычно это имеет место для метильных групп СН3, соединенных с оставшейся частью молекулы одинарной а-связью. Например, в молекуле этана две группы СН3 могут поворачиваться вокруг связи С-С. [13]
Из параметра асимметрии г) может быть получена информация о тг-связывании. Одинарная а-связь с галогеном должна приводить к аксиально-симметричному градиенту поля. Двойные связи ведут к асимметрии, и т зависит от степени тг-связывания. Берсон [31], исходя из г), провел подробное исследование проблемы качественной оценки степени л-связывания углерод - галоген. [14]
Окисление диеновых каучуков протекает под влиянием кислорода воздуха уже при комнатной температуре и приводит к отвердеванию и хрупкости поверхностного слоя. На начальных стадиях окислительная деструкция натурального каучука характеризуется размягчением материала и появлением липкости, в дальнейшем эластичность каучука уменьшается и он растрескивается. Окисление каучуков происходит как по двойным связям, так и по одинарной а-связи у третичного атома углерода. [15]
Страницы: 1 2