А-тип
Cтраница 2
Ошибка I рода ( а-типа) может быть сделана только тогда, когда Н0 верна, поскольку по определению этот тип ошибки связан с неверным отклонением истинной нулевой гипотезы. [16]
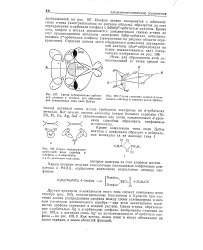
МО, причем все а-типа, так как максимумы электронной плотности оказываются на осях, соединяющих ядра С, с одной стороны, и Н, с другой. В соответствии с тем, что участвующие в перекрывании АО С находятся на двух энергетических уровнях, образующиеся МО также имеют два уровня, как показано на рисунке. И электроны в молекуле ( их всего 8) размещаются на этих двух уровнях, связывающих МО. Все атомы Н эквивалентны, поэтому они симметрично располагаются вокруг центрального атома так, чтобы отталкивающиеся области максимальной электронной плотности находились на наибольшем удалении друг от друга. Это требование реализуется, если ядра атомов водорода находятся в вершинах тетраэдра, центром которого служит ядро атома С. [17]
Это расщепление называется удвоением А-типа. [18]
Радикалы бывают я-типа и а-типа. [19]
Селеновые вентили на алюминиевой основе А-типа ( старое обозначение ABC) и Г - типа ( старое обозначение ТВС) выпускаются в виде выпрямительных столбиков, собранных из элементов квадратной формы по определенной схеме выпрямления. [20]
В этом случае к молекулярным орбиталям а-типа добавляются молекулярные орбитали я-типа. Орбитали лигандов, способные к я-перекрыванию - это, например, р - и d - атомные орбитали или молекулярные ясв-ияразр-орбитали двухъ-ядерных молекул. [21]
Онзагера, свойственных наиболее распространенным силам а-типа; реже встречающимся силам р-типа свойственны коэффициенты Казимира. [22]
На рис. 74 показаны возможные комбинации а-типа валентных орбиталей центрального атома и отвечающие им по симметрии сочетания орбиталей лигандов. Если совместить изображения соответствующей орбитали центрального атома и изображение орбиталей лигандов, то возникает картина их перекрывания. Как видно на рис. 74, s - op - биталь комплексообразователя благодаря сферической симметрии одинаково перекрывается с орбиталями каждого из шести лигандов, расположенных по осям октаэдра. [24]
 |
Молекула метана. [25] |
Химические связи в метане относятся к а-типу. Связи характеризуются тем, что их электронная плотность концентрируется между связываемыми атомами по линии, проходящей через их центры. Связи отвечают максимально возможной степени перекрывания атомных орбиталей, поэтому достаточно прочны. Перекрывание атомных орбиталей при образовании связи в молекуле можно сравнить с наверняка известной Вам липучкой, которая часто используется как застежка на одежде. [26]
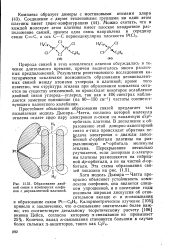 |
Образование двойной связи в комплексах олефинов с двухвалентной платиной. [27] |
В дополнение к образованию этой донорно-акцепторной связи а-типа происходит обратная передача электронов с дважды заполненной rf - орбитали платины на разрыхляющую я - орбиталь молекулы этилена. Перекрывание несколько улучшается, если донорные я-электро-ны платины размещаются на гибридной rfp - орбитали, а не на чистой d - op - битали. [28]
Олефин двояко связывается с платиной: связь а-типа ( заштрихованная на рисунке область) образуется за счет перекрывания я-орбитали олефина с 5Йб5бр2 - орбиталью платины. [30]
Страницы: 1 2 3 4 5