А-тип
Cтраница 3
Этот тип ошибки называется ошибкой I рода или ошибкой а-типа. [31]
При этом могут возникать следующие связывающие и разрыхляющие орбитали а-типа ( соответственно og и ou): lsog, lsa, 2sag, 2sau, 2pxag и 2pxau - Орбитали приведены в порядке возрастания энергии. [32]
Банановая связь ( Т - связь) - связь а-типа, не имеющая максимального перекрывания атомных орбиталей, составляющих эту связь, поскольку они не направлены вдоль межъядерной оси. Такая связь существует, в частности, между атомами углерода в циклопропане. [33]
А-типа твердые растворы; з - гексагональный твердый раствор А-типа; 4 - твердый раствор В-типа и примесь твердых растворов А-i Мп О3 - типов; s - кубический типа пи-рохлора и кубический типа Мп2О3 твердые растворы; в - твердый раствор типа пи-рохлора. [34]
Комбинация двух d - AO также может осуществляться по а-типу с образованием Jd - МО и сг - МО сложной формы. [35]
Здесь рассмотрены феноменологические коэффициенты Онзагера, свойственные наиболее распространенным силам а-типа. Более редко встречающимся силам р-типа соответствуют коэффициенты Казимира. [36]
 |
Форма электронных облаков связывающих и. [37] |
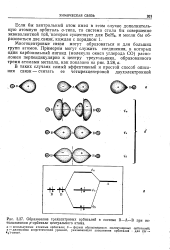
Из атомных s - орбиталей могут образоваться молекулярные орбитали только а-типа. Обратное неверно, так как молекулярные о-орбитали могут образовываться и при участии любых типов атомных орбиталей, в том числе и гибридных, причем последние обеспечивают более эффективное перекрывание по линии связи. На рис. 21 приведена схема перекрывания электронных облаков при образовании а-связей с участием р-орбиталей и гибридных орбиталей. На рис. 22 изображены электронные облака связывающих и разрыхляющих ст-орбиталей, образованных двумя s - или двумя р-ор-биталями. [38]
 |
Форма электронных облаков связывающих и. [39] |
Из атомных s - орбиталей могут образоваться молекулярные орбитали только а-типа. Обратное неверно, так как молекулярные о-орбитали могут образовываться и при участии любых типов атомных орбиталей, в том числе и гибридных, причем последние обеспечивают более эффективное перекрывание по линии связи. На рис. 21 приведена схема перекрывания электронных облаков при образовании а-связей с участием р-орбиталей и гибридных орбиталей. На рис. 22 изображены электронные облака связывающих и разрыхляющих ст-орбиталей, образованных двумя s - или двумя р-ор-биталями. [40]
А - электронное сродство атома; PII - плотность электронов А-типа ядра i, имеющего тг-электроны; Zk - соответствующий: заряд ядра; ynh - одноцентровый интеграл взаимодействия га-электрона с - электроном ( я, о, п) 2 ри - плотность электронов на соседнем it - атоме; у - кулоновский интеграл взаимодействия га-электрона с соседними атомами; Qmn - кулоновский интеграл взаимодействия соседних ядер. [41]
 |
Образование трехцентровых орбиталей в системе В-А - В при использовании jo - орбитали центрального атома. [42] |
Если бы центральный атом имел в этом случае дополнительную атомную орбиталь а-типа, то система стала бы совершенно эквивалентной той, которая существует для ВеРЬ, и могли бы образоваться две. [43]
Так, например, по данным расчета низшая вакантная МО этилена оказывается орбиталью а-типа, а не я-типа. [44]
 |
Однородное распределение микродефектов Л - типа 9 поперечном ( а н продольном ( 6 сечениях монокристалла кремния. X 1 0. [45] |
Страницы: 1 2 3 4 5