Диа-стереомер
Cтраница 1
Диа-стереомеры в отличие от энантиомеров имеют различные физические свойства и различные величины удельного вращения. [1]
В данном случае оба диа-стереомера дают траноолефин. [2]
В данном случае оба диа-стереомера дают грамс-олефин. [3]
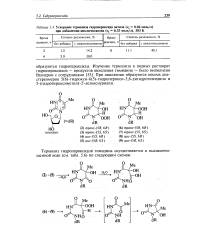 |
Ускорение термолиза гидропероксида октила ( сс моль / л при добавлении циклогексанона ( с моль / л, 383 К. [4] |
При окислении образуются восемь диа-стереомеров 5 ( 6) - гидрокси-6 ( 5) - гидроперокси-5 6-дигидротимидина и 5 - ( гидропероксиметил) - 2 -дезоксиуридин. [5]
Исследование особенностей пространственного строения диа-стереомеров, проведенное на моделях Дрейдинга, показало, что в то время как / иранс-изомер имеет полностью жесткую структуру, не допускающую пространственного отклонения взаимодействующих метильных радикалов, ммс-изомер более подвижен и может путем частичного дугообразного изгиба основной углеродной цепи, приводящего к пространственному удалению замещающих метильных радикалов, несколько уменьшить указанные выше взаимодействия. Так как взаимодействия эти составляют в сумме величину, равную 7000 - 7500 кал / моль, то даже частичное их уменьшение должно привести к большому энергетическому выигрышу. Интересно, что при синтезе 2 2 3 4 5 5-гексаметилгексана в большом количестве получается неустойчивый ( транс. [6]
Это позволяет сравнительно легко отделять диа-стереомеры друг от друга обычными приемами - чаще всего с помощью кристаллизации, адсорбции. [7]
Во многих случаях для определения конфигурации диа-стереомеров их переводят в циклические производные, уменьшая тем самым конформационную подвижность. Из трео-и эритро-форм в этом случае получают производные, различающиеся ориентацией заместителей относительно цикла. Эту ориентацию довольно легко установить методом ЯМР, используя общую закономерность: чем ближе друг к другу находятся взаимодействующие протоны, тем меньше константы спин-спинового расщепления. [8]
Во многих случаях для определения конфигурации диа-стереомеров их переводят в циклические производные, уменьшая тем самым конформационную подвижность. Из трео-и э / шгро-форм в этом случае получают производные, различающиеся ориентацией заместителей относительно цикла. Эту ориентацию довольно легко установить методом ЯМР, используя общую закономерность: чем ближе друг к другу находятся взаимодействующие протоны, тем меньше константы спин-спинового расщепления. [9]
В общем, получение чистых цыс-грянс-изомеров или диа-стереомеров - задача экспериментально не всегда легкая, но в принципе не отличающаяся от обычного выделения в индивидуальном виде любых органических веществ. [10]
В общем, получение чистых цис-транс-нзоыероъ или диа-стереомеров - задача экспериментально не всегда легкая, но в принципе не отличающаяся от обычного выделения в индивидуальном виде любых органических веществ. [11]
В ряду би - и полициклических соединений также существуют диа-стереомеры, возникающие благодаря наличию нескольких асимметрических атомов углерода. [12]
Если не удалось получить в оптически активной форме один из диа-стереомеров. Иными словами, только положительный результат - получение оптически активного вещества, может служить основанием для суждений о конфигурации. [13]
Применяя хиральные сдвигающие реагенты, можно непосредственно ( без превращения в диа-стереомеры) определять энантиомерную чистоту многих соединений, способных к комплексообразованию. [14]
Недавно было показано [ 1521, что величины К комплексов четырех диа-стереомеров дициклогексил-18 - краун-6 с NaCl, KC1 nCsCl располагаются в следующем порядке: цчс-син-цис ( изомер А) цис-анти-цис ( изомер Б) тптс-син-транс транс-ант-транс. [15]
Страницы: 1 2 3