Комплекс - кальций
Cтраница 3
Превращение фибриногена в фибрин происходит под влиянием тромбина и в отсутствие кальция. Роль ионов кальция или комплексов кальция [61] в первой фазе свертывания еще не вполне ясна. [31]
БН ( формула приведена на стр. Присутствие трибутилфосфата способствует растворению комплекса кальция с азо-азокси БН в органической фазе. Во время экстракции наблюдается сравнительно небольшое изменение окраски органической фазы с оранжево-красной, присущей азо-азокси БН, на красную, характерную для комплекса кальция с азо-азокси БН. [32]
При этом происходит ослабление окраски раствора реагента, что используется в фотометрическом анализе. Флотирующийся осадок, представляющий собой комплекс кальция с азо-азокси - БН, растворяется в некоторых полярных растворителях или в их смеси с неполярными. При этом кальций количественно извлекается в органическую фазу. [33]
Более или менее чувствительно пурпурат взаимодействует с Li, Sr, Ва, Zn, Cd, Cu, Ni, Co, Fe ( II или III), Mn, Sn ( II) и Mg. Магниевый комплекс более сильно диссоциирует, чем комплекс кальция, однако значительные количества магния мешают определению. Светопоглощение при 505 мц, пурпурата магния аналогично светопоглощению реагента 1В, так что при измерении светопоглощения при этих длинах волн небольшие количества магния совсем или почти совсем не оказывают влияния. [34]
Для титрования кальция и магния в смеси используют малую растворимость гидроокиси магния. Комплекс магния с ЭДТА разлагается едкой щелочью, выделяя гидроокись магния, тогда как комплекс кальция с ЭДТА устойчив, так как гидроокись кальция лучше растворима в воде. При рН 10 ( в среде аммиачного буфера) титруют сумму кальция и магния. К другой части испытуемого раствора прибавляют едкую щелочь ( без карбонатов) и после осаждения гидроокиси магния титруют кальций. [35]
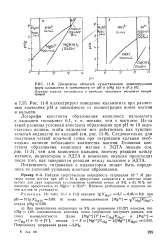 |
Диаграммы областей существования доминирующих. форм кальмагита в зависимости от рН и pMg ( а и рСа ( б. [36] |
Следовательно, для получения четкой конечной точки при титровании кальция необходимо наличие небольшого количества магния. Условная константа образования комплекса магния с ЭДТА меньше ( см. рис. 11 - 3), чем для комплекса кальция, поэтому реакция между магнием, индикатором и ЭДТА и изменение окраски происходят после того, как завершится реакция между кальцием и ЭДТА. [37]
 |
Устойчивость комплексов состава MR в зависимости от радиусов катионов с электронной конфигурацией типа инертного газа ( приведены lg Pi. [38] |
Из данных табл. 13.1 следует, что при равных радиусах катионов комплексообразователей устойчивость комплексов тем больше, чем больше заряд катиона. Так, радиусы ионов кальция и иттрия одинаковы, но устойчивость комплексов иттрия с ЭДТА значительно выше, чем комплекса кальция с этим же лигандом. Такие соотношения справедливы и для комплексов ЭДТА со стронцием и лантаном, катионы которых почти не различаются по размерам, но имеют неодинаковые заряды. [39]
Хендриксон и Баллоу [168] использовали колонку с диэтил-аминоэтилцеллюлсзой для выделения трех инозитидсв ( производных циклогексангексола) из человеческого и бычьего мозга. Первым вымывался комплекс кальция с фосфоинозитидом, пик которого был хорошо отделен от других соединений. За ним следовали два сильно перекрывающихся пика двух неидентифицированных липоидов, а потом почти количественно разделенные пики ди - и трифосфоинозитидов. [40]
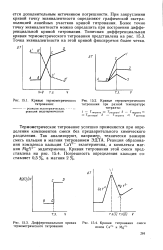 |
Кривые термометрического [ IMAGE ] Кривые термометрического.| Дифференциальная кривая термометрического титрования.| Кривая титрования смеси ионов Са2 и Mg2. [41] |
Термометрическое титрование успешно применяется при определении компонентов смеси без предварительного химического разделения. Так анализируют, например, технически важную смесь кальция и магния титрованием ЭДТА. Реакция образования комплекса кальция CaY2 - экзотермична, а комплекса магния MgY2 - эндотермична. [42]
Наиболее быстрый объемный метод определения кальция - комплексонометрический. Конец титрования определяют при помощи индикатора мурексида или кислотного хрома темно-синего, которые дают с кальцием окрашенные комплексы, разлагаемые трилоном. В эквивалентной точке красноватая окраска комплекса кальция с индикатором полностью разрушается и раствор приобретает сиреневую окраску, характерную для самого индикатора. При этом титровании магний не реагирует с трилоном, а выделяется в виде осадка гидроокиси. Большие количества этого осадка несколько затрудняют титрование, так как он способен адсорбировать кальций и индикатор из раствора и отдавать их в раствор очень медленно. [43]
На основании экспериментальных данных и теоретических предпосылок [1-4, 39, 41-43] было показано, что устойчивость комплекса с изменением радиуса центрального атома может увеличиваться, уменьшаться или проходить через максимум. Практически существуют некоторые оптимальные соотношения размеров взаимодействующих агентов, которые обеспечивают максимальную устойчивость комплекса при прочих равных условиях. Так, в ряду этиленди-аминтетрацетатов щелочноземельных металлов максимальной устойчивостью обладает комплекс кальция, в ряду переходных металлов - меди или железа, в ряду редкоземельных элементов [40,41, 44] - лютеция. [44]
На рис. 7 показана кривая функциональной зависимости величины р / ( комплекса цинка с ЭДТА от рН раствора. Кривая показывает, что комплекс наиболее устойчив при рН от 6 до 10 и разрушается как в сильнокислых, так и в сильнощелочных растворах. Для сравнения на той же диаграмме приведена аналогичная кривая для комплекса кальция с ЭДТА, более детально показанная на рис. 6 ( стр. [45]
Страницы: 1 2 3 4