Шведский ученый аррениус
Cтраница 1
Шведский ученый Аррениус создал теорию электролитической диссоциации, изложенную им в 1887 г. Основные положения этой теории следующие. [1]
Шведский ученый Аррениус в 1887 г. объяснил отступления электролитов от законов разбавленных растворов обратимым распадом электролитов на ионы под влиянием растворителя; вследствие этого число осмотически деятельных частиц возрастает, что зависит от степени диссоциации электролита в данных условиях. Распад на ионы называется электролитической диссоциацией. Степень диссоциации - это доля молекул, распавшихся на ионы при равновесии. Соли диссоциируют на катионы металлов и анионы кислотных остатков. Кислоты образуют катионы водорода и кислотные остатки в качестве анионов, основания образуют гидроксильные отрицательные ионы и металлические положительные ионы. [2]
Шведский ученый Аррениус предположил, что к реакции должны приводить не любые, а только эффективные столкновения частиц, число которых составляет малую долю от общего числа столкновений. Столкновение может быть эффективным, если оно происходит между молекулами, обладающими некоторым избытком энергии по сравнению со средней энергией молекул в рассматриваемой системе при данной температуре. Молекулы, несущие в себе эту избыточную энергию, называются активными, а сам избыток энергии - энергией активации. [3]
Шведский ученый Аррениус в 1887 г. объяснил отступления электролитов от законов разбавленных растворов обратимым распадом электролитов на ионы под влиянием растворителя; вследствие этого число осмотически деятельных частиц возрастает, что зависит от степени диссоциации электролита в данных условиях. Раедад на ионы называется электролитической диссоциацией. [4]
В 1887 г. шведский ученый Аррениус сформулировал теорию электролитической диссоциации, согласно которой водные растворы электролитов содержат главным образом свободные ионы. Эта идея совершила коренной переворот в установившихся воззрениях и, дав удивительно простое объяснение многим свойствам растворов, оказалась исключительно плодотворной для науки. [5]
В 1883 г. шведский ученый Аррениус установил, что ионы возникают не под действием электрического тока, а обнаруживаются даже при растворении в воде некоторых веществ. К таким веществам относятся кислоты, соли, основания. Теория Аррениуса получила название теории электролитической диссоциации, а вещества, распадающиеся ( диссоциирующие) на ионы при растворении их в воде, - электролитами. В дальнейшем было установлено, что электролиты и в кристаллическом виде состоят из ионов. Электролиты, находясь в растворе, обмениваются ионами. Например, если растворить в воде две соли - сульфат калия I2SO4 и поваренную соль ( хлористый натрий) NaCl, то никаких внешних признаков химической реакции между этими веществами не будет обнаружено. [6]
В 1887 г. шведский ученый Аррениус ( 1859 - 1927 гг.) предложил теорию электролитической диссоциации, сущность которой сводится к следующему: вещества, растворы которых являются электролитами, при растворении распадаются на частицы ( ионы), несущие положительные или отрицательные заряды. [7]
В 1887 г. шведский ученый Аррениус ( 1859 - 1927 гг.) предложил теорию электролитической диссоциации, сущность которой сводится к следующему: вещества, растворы которых являются электролитами, при растворении распадаются на частицы ( ионы), несуш ие положительные или отрицательные заряды. [8]
В 1887 г. шведский ученый Аррениус ( 1859 - 1927 гг.) предложил теорию электролитической диссоциации, сущность которой сводится к следующему: вещества, рас творы которых являются электролитами, при растворении распадаются на частицы ( ионы), несущие положительные и отрицательные заряды. [9]
Такое предположение впервые было высказано в 1887 г. шведским ученым Аррениусом и легло в основу его теории, объясняющей поведение солей, кислот и оснований в водных растворах. [10]
Такое предположение впервые было высказано в 1887 г. шведским ученым Аррениусом и легло в основу его теории, объясняющей поведение солей, кислот и оснований в водных растворах. [11]
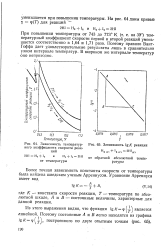 |
Зависимость температур - [ IMAGE ] Зависимость lg / С реакции ного коэффициента скорости реак. [12] |
Более точная зависимость константы скорости от температуры была найдена шведским ученым Аррениусом. [13]
Один из наиболее убедительных аргументов, выдвинутых в 1887 г. шведским ученым Аррениусом в поддержку теории электролитической диссоциации, основывался на том, что наблюдается значительно большее понижение температуры замерзания растворов солей, чем значение, вычисленное для недиссоциированных молекул. Для таких солей, как NaCl и MgS04, в очень разбавленном растворе наблюдается в два раза большее понижение температуры замерзания, а для солей, подобных Na2S04 и СаС12 - точно в три раза большее, чем можно было бы ожидать. [14]
Причина такого ненормального поведения солей, кислот и щелочей в водных растворах была раскрыта теорией, разработанной в 1886 г. шведским ученым Аррениусом. [15]
Страницы: 1 2