Дырочный комплекс
Cтраница 2
Кислородный ион в активированном состоянии ( на вершине потенциального барьера) может вновь забирать электрон у любого из окружающих его двухвалентных ионов с образованием дырочного комплекса. [16]
Полупроводниковые и каталитические свойства окисных твердых растворов связаны с образованием соединения типа ( Li - - 0 - Т3 О ], который впредь мы будем называть дырочным комплексом и обозначать в квадратных скобках. Структура дырочного комплекса показывает, что соединение содержит два неравноценных атома кислорода. Один из них связан с ионом переходного металла таким же образом, как в обычных окислах этих металлов, другой обусловлен внедрением лития ( вообще литий-подобного иона) и появлением дырки и находится между ними. [17]
Согласно приведенным схемам электрохимического восстановления кислорода на катализаторах с дырочными комплексами, скорость этого процесса и активность кислородного электрода определяются количеством ионогенных групп [ Т3 О ] ( следо-вательно, концентрацией дырочного комплекса) и энергией активации процессов дырочного перехода. Отсюда ясно, что дырочный комплекс является активным центром катализатора. Таким образом, твердые растворы, которые используются в качестве ката лизаторов кислородных электродов, должны обладать максимально возможным числом дырочных комплексов с наибольшей подвижностью дырок и кислорода. В этом отношении величина электропроводности может служить индикатором активности катализаторов, ибо, как было показано, она в такой же степени определяется концентрацией дырок и величиной энергии активации процесса и, следовательно, скоростью обмена зарядами между дырочным комплексом и двухвалентными ионами мет алла. [18]
Полупроводниковые и каталитические свойства окисных твердых растворов связаны с образованием соединения типа ( Li - - 0 - Т3 О ], который впредь мы будем называть дырочным комплексом и обозначать в квадратных скобках. Структура дырочного комплекса показывает, что соединение содержит два неравноценных атома кислорода. Один из них связан с ионом переходного металла таким же образом, как в обычных окислах этих металлов, другой обусловлен внедрением лития ( вообще литий-подобного иона) и появлением дырки и находится между ними. [19]
Согласно приведенным схемам электрохимического восстановления кислорода на катализаторах с дырочными комплексами, скорость этого процесса и активность кислородного электрода определяются количеством ионогенных групп [ Т3 О ] ( следо-вательно, концентрацией дырочного комплекса) и энергией активации процессов дырочного перехода. Отсюда ясно, что дырочный комплекс является активным центром катализатора. Таким образом, твердые растворы, которые используются в качестве ката лизаторов кислородных электродов, должны обладать максимально возможным числом дырочных комплексов с наибольшей подвижностью дырок и кислорода. В этом отношении величина электропроводности может служить индикатором активности катализаторов, ибо, как было показано, она в такой же степени определяется концентрацией дырок и величиной энергии активации процесса и, следовательно, скоростью обмена зарядами между дырочным комплексом и двухвалентными ионами мет алла. [20]
Хемосорбция кислорода на поверхности окислов с литийподобными ионами в основном должна идти по механизму образования твердых растворов, при котором внедряется кислород с образованием дырочных комплексов. Однако здесь, как отмечалось, имеются некоторые специфические особенности. [21]
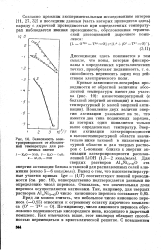 |
Зависимость электропроводности от абсолютной температуры для различных систем. [22] |
Вывод о том, что высокотемпературные участки кривых Igo - ( 1 / 2) соответствуют ионной проводимости ( см. рис. 10), непосредственно подтверждается данными по определению чисел переноса. Оказалось, что значительная доля переноса осуществляется катионами. По-видимому, число анионного переноса обусловлено подвижностью кислородного иона, входящего в дырочный комплекс. Как отмечалось выше, этот кислород обладает способностью перемещаться в кристаллической решетке. [23]
Согласно приведенным схемам электрохимического восстановления кислорода на катализаторах с дырочными комплексами, скорость этого процесса и активность кислородного электрода определяются количеством ионогенных групп [ Т3 О ] ( следо-вательно, концентрацией дырочного комплекса) и энергией активации процессов дырочного перехода. Отсюда ясно, что дырочный комплекс является активным центром катализатора. Таким образом, твердые растворы, которые используются в качестве ката лизаторов кислородных электродов, должны обладать максимально возможным числом дырочных комплексов с наибольшей подвижностью дырок и кислорода. В этом отношении величина электропроводности может служить индикатором активности катализаторов, ибо, как было показано, она в такой же степени определяется концентрацией дырок и величиной энергии активации процесса и, следовательно, скоростью обмена зарядами между дырочным комплексом и двухвалентными ионами мет алла. [24]
Как отмечалось, приведенное распределение прочности связей является одним из возможных вариантов его. Однако нетрудно проверить, что любой вариант распределения, не нарушающий наши первоначальные условия, приводит лишь к изменению ориентации дырочного комплекса, что в конечном счете означает перескок дырки, замену одного подвижного кислорода другим или же то и другое. [26]
Ионы А13 фактически служат воротами внедрения кислорода. Вычисление показало, что энтропия активации составляет 3 ккал / молъ. Эти кривые показывают, что и в данном случае имеется хорошее совпадение теоретических и экспериментальных данных. В разделе 3 было показано что при высоких температурах идет процесс диссоциации дырочных комплексов. [27]
Катализаторы кислородного электрода топливных элементов на основе окислов металлов переменной валентности и окислов щелочных и других металлов являются весьма перспективными для широкого использования. Исследованы каталитические, полупроводниковые и коррозионные свойства систем типа СиО - Li. Изучены механизм и энергия активации образования дырочного перехода и каталитического процесса окисления. Рассмотрены вопросы подвижности кислорода и механизма его внедрения в твердые растворы, термическая диссоциация дырочных комплексов, хемосорбция кислорода, поверхностная электропроводность и каталитическая активность окисных. [28]
Прежде всего этот кислородный ион представляет собой одно целое, в то время как двойная связь в Ш3 0 принадлежит не одному кислороду, а является совокупностью пяти кислородных связей 2 / 3, Vsi Vs. Кислородный ион благодаря большой прочности связи ( равной единице) с Ni3 при колебательном движении имеет возможность более близко подойти к Ш3 и сравнительно легко обменяться зарядом. Это приводит к образованию активированного комплекса со сравнительно малой энергией, в который входит нестабильный одновалентный ион кислорода. Такой кислород способен захватить электрон у любого из окружающих его ионов Ni24 с образованием вновь дырочного комплекса той или иной Ориентации. Такой же способностью обладают и другие ионы кислорода, однако при этом требуется большая энергия активации. [29]
Согласно приведенным схемам электрохимического восстановления кислорода на катализаторах с дырочными комплексами, скорость этого процесса и активность кислородного электрода определяются количеством ионогенных групп [ Т3 О ] ( следо-вательно, концентрацией дырочного комплекса) и энергией активации процессов дырочного перехода. Отсюда ясно, что дырочный комплекс является активным центром катализатора. Таким образом, твердые растворы, которые используются в качестве ката лизаторов кислородных электродов, должны обладать максимально возможным числом дырочных комплексов с наибольшей подвижностью дырок и кислорода. В этом отношении величина электропроводности может служить индикатором активности катализаторов, ибо, как было показано, она в такой же степени определяется концентрацией дырок и величиной энергии активации процесса и, следовательно, скоростью обмена зарядами между дырочным комплексом и двухвалентными ионами мет алла. [30]
Страницы: 1 2
