Наблюдаемая константа - скорость
Cтраница 1
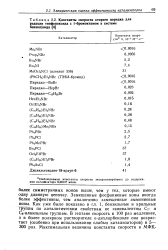 |
Константы скорости второго порядка для реакции тиофеноксида с 1-бромоктаном в системе бензол / вода ( 4 ]. [1] |
Наблюдаемые константы скорости экстраполированы до содержания катализатора 0 00137 моля. [2]
Наблюдаемая константа скорости непосредственно определяется стадией переноса протона от субстрата к основанию. [3]
Наблюдаемая константа скорости оказывается пропорциональной среднему геометрическому между константами скорости химической реакции и внутренней диффузии. Поскольку последняя мало зависит от температуры, то эффективная энергия активации в собственно внутридиффузион-ной области равна примерно половине энергии активации химической реакции. [4]
 |
Соотношение между. [5] |
Наблюдаемая константа скорости почти в 00 раз больше, и реакция, вероятно, протекает по внутрисферному механизму. [6]
Наблюдаемые константы скорости для лимитируемых диффузией реакций подтверждают, по меньшей мере качественно, ожидаемую связь с изменением вязкости растворителя с температурой. Для обычных лимитируемых диффузией реакций в таких растворителях, как СС14, гексан, бензол и метил-метакрилат, кажущиеся энергии активации составляют около 2 - 3 ккал / молъ. [7]
Наблюдаемая константа скорости К имеет размерность давление - время 1 и пропорциональна количеству катализатора ( через S), а также обратно пропорциональна объему V газовой фазы. [8]
Наблюдаемая константа скорости сольволиза при 99 7 С в 80 % - ном водном ацетоне равна 1 17 - 10 - 6 с-1, скорость же рацемизации в 4 раза больше, так что при 50 % - ном прохождении реакции исходное вещество оказывается на 96 % рацемизованным. [9]
Если наблюдаемые константы скорости и отличаются от вычисленных констант образования ионных пар, то получаются величины, очень близкие к константам скорости водного обмена, вообще в пределах точности вычисленных констант образования ионных пар. Более того, найдено, что энергия активации и энтропия по существу одинаковы для обоих процессов. [10]
Соответственно наблюдаемая константа скорости является мерой конформационных изменений, и из исследования инактива-ционных процессов можно получить информацию о конформационных состояниях молекулы белка. [11]
Значения наблюдаемых констант скорости как функций рН приведены в цитируемых работах; однако не имеется данных в отсут - ствие ПАВ. [12]
Постоянство наблюдаемой константы скорости в кинетической области возможно, например, при использовании уравнений нулевого и первого порядка по объемной концентрации или уравнения с торможением продуктом. В работе [ 59J определены скорости крекинга кумола в кинетической области для наполнителя, матрицы, смешанного катализатора. При величинах W / y 20 2 ммоль / г сек и WH 73 7 ммоль / г сек для смешанного катализатора, содержа - щего - 10 % наполнителя, экспериментально измеренная скорость процесса VV составила 27 5 ммоль / г сек. По мере увеличения скорости крекинга ( с увеличением пористости наполнителя) возможен переход из кинетической области в диффузионную с некоторым торможением процесса. [13]
Чувствительность наблюдаемой константы скорости к изменениям концентрации субстрата, конечно, зависит от величины константы равновесия для образования комплекса. [14]
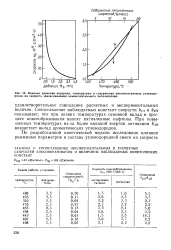 |
Влияние давления водорода, температуры и содержания циклопснтановых углеводородов на скорость закоксовывания алюмоплатинового катализатора. [15] |
Страницы: 1 2 3 4