Диаграмма - растворимость - система
Cтраница 4
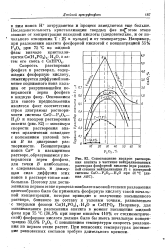
Скорость растворения фосфата в растворах, содержащих фосфорную кислоту, лимитируется диффузией наименее подвижного иона кальция от разрушающейся поверхности зерна фосфата в жидкую фазу. Основанием для такого предположения является факт соответствия строя диаграммы растворимости системы СаО - Р205 - Н20 и изохрон растворения апатита ( рис. 82) - максимум скорости растворения апатита практически совпадает с положением узловой точки В на диаграмме растворимости. [47]
Теперь исследуется количественно какое-нибудь свойство системы, состав которой изображен точками треугольника; например, определяется растворимость полученного вещества, и эта величина помечается у соответствующей точки. Соединяют линией точки с одинаковой растворимостью и получают диаграмму растворимости системы из трех компонентов. Можно количественный признак отложить на перпендикулярах, восстановленных из точек, и через вершины, перпендикуляров провести поверхность - получится пространственная диаграмма: растворимость-состав. Опыт ведется следующим образом: берутся три компонента и всегда смешиваются так, чтобы сумма по весу в граммах, молях или по объему всегда была величиной постоянной, а отношение А: В: С соответствовало составу точек треугольника. [48]
Рассмотрим возможные пути реализации конверсионного цикла. Для этого обратимся к рисунку, где на квадрат составов нанесена проекция изобарического сечения диаграммы растворимости системы К, Na Cl, N03 - - Н20 [6] и проекция изотермического сечения той же диаграммы. [49]
Взаимодействие природных фосфатов с фосфорной кислотой протекает нацело только при кристаллизации из раствора одно-замещенного фосфата кальция. При насыщении раствора дикаль-цийфосфатом ( или даже в смеси его с монокальцийфосфатом, когда состав раствора соответствует эвтонической точке на диаграмме растворимости системы СаО - РаО5 - НаО), разложение фосфата практически прекращается. [50]
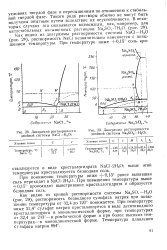 |
Диаграмма растворимости двойной системы NaCl - Н2О.| Диаграмма растворимости двойной системы Na2SO4 - h O. [51] |
Такого рода растворы обычно не могут быть получены опытным путем вследствие их неустойчивости. В некоторых случаях это оказывается возможным, как, например, для метастабильных насыщенных растворов Na. Как видно из диаграммы растворимости системы NaCl - H2O ( рис. 2К), растворимость NaCl незначительно изменяется с повышением температуры. [52]
Однако подавляющему большинству потребителей требуется поташ первого сорта. Для получения такого поташа из раствора состава Гю0 предварительно необходимо выделить хлорид. В соответствии с диаграммой растворимости системы точка Гюо находится в поле кристаллизации хлорида калия при температурах ниже 100 С. Поэтому хлорид калия может быть выделен охлаждением раствора Гюо до более низких температур. При этом фигуративная точка состава раствора должна перемещаться по линии кристаллизации хлорида калия, проходящей через полюс его кристаллизации и точку Гюо. [53]
 |
Диаграмма растворимости. [54] |
Взаимная растворимость ограниченно растворимых жидкостей изменяется с температурой; она может увеличиваться ( фенол - вода) или уменьшаться ( триэтиламин - вода) при повышении температуры. Температура, при которой жидкости растворяются во всех отношениях, называются критической температурой. Зависимость взаимной растворимости ограниченно смешивающихся жидкостей от температуры лучше всего выразить графически в виде диаграммы растворимости. На рис. 13 приведена диаграмма растворимости системы фенол - вода. На абсциссе откладывают состав смеси в весовых или мольных процентах, на ординате - температуру. [55]
Каждый из этих треугольников изображает тройную невзаимную систему из воды и двух компонентов. Так как оба треугольника имеют общую сторону НОН - MX, то и растворимость компонента MX в воде, выражаемая точками е, на обеих диаграммах будет одинакова. Совместив две треугольные изотермы растворимости по гипотенузе НОН - MX, получим диаграмму растворимости тройной взаимной системы типа Иенеке, причем точки е обоих треугольников в силу отмеченного их свойства совпадут в одну точку. Участки изотермы растворимости еЕ1 и еЕ2, являющиеся зеркальными отображениями, составят одну кривую. На изотерме растворимости имеется также поле ненасыщенного раствора Ж и поля трехфазных равновесий Ж МОН MX и Ж НХ - f - MX, характерные для диаграмм растворимости тройных невзаимных систем. [57]
Страницы: 1 2 3 4