Диаграмма - состояние - вещество
Cтраница 2
Условия опыта могут изменить диаграмму состояния вещества, выражающую связь между концентрацией и температурой, и тем самым свойства этого вещества. [16]
 |
Зависимость молярных до. [17] |
Анализ экспериментальных данных по диаграммам состояния веществ ( см., например, [8]) показывает, что температурная область гомогенности жидкостей достаточно широка. Кроме того, установлено, что при температурах кристаллизации из раствора одного из компонентов ( Т 2860 К для СаО и Т 2196 К, для ВаО) состав и термодинамические функции системы практически не зависят от предположения о фазности системы. Это подтверждается также и для других систем, как это видно на рис. 2, на котором представлены числа молей компонентов SiO. [18]
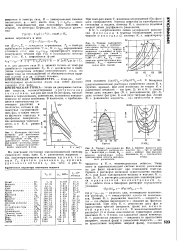
На рис. 42 показана часть диаграммы состояния вещества с моно-тропными модификациями: Oi02B - кривая давления пара жидкости; OJ) - кривая плавления стабильной модификации 2 А - недостижимая точка превращения, лежащая выше точек плавления Ох и 02 обеих модификаций. Метастабильные моновариантные линии равновесий с участием модификации 1 показаны редким пунктиром. Из рисунка видно, что при одной и той же температуре давление пара неустойчивой модификации 1 выше, чем стабильной. [19]
На рис. 42 показана часть диаграммы состояния вещества с моно-тропными модификациями: О В - кривая давления пара жидкости; 02D - кривая плавления стабильной модификации 2; А - недостижимая точка превращения, лежащая выше точек плавления Oj и 02 обеих модификаций. Метастабильные моновариантные линии равновесий с участием модификации / показаны редким пунктиром. Из рисунка видно, что при одной и той же температуре давление пара неустойчивой модификации 1 выше, чем стабильной. [20]
Чем определяется наклон линий на диаграмме состояния вещества для завлсимости Тпл от давления. [21]
Чем определяется наклон линий на диаграмме состояния вещества для зависимости Тш, от давления. [22]
Чем определяется наклон линий на диаграмме состояния вещества для зависимости 7ПЛ от давления. [23]
КРИТИЧЕСКАЯ ТОЧКА - точка на диаграмме состояния веществ, соответствующая критическому состоянию, в к-ром две ( или более) фазы, находящиеся в термодинамич. [25]
Такого рода системы координат обычно называют диаграммами состояния вещества. [26]
Располагая значениями s, можно построить такие диаграммы состояния веществ, в которых по одной из координатных осей откладывается величина энтропии. Эти диаграммы состояния ( их иногда называют энтропийными диаграммами) находят широкое применение в расчетах термодинамических - процессов. [27]
Кривые ТА, ТБ и ТВ разделяют диаграмму состояния вещества на три области: / - область существования твердой фазы, / / - жидкой фазы и / / / - парообразной фазы. Точка Т, где сходятся все три области, указывает температуру и давление, при которых могут находиться в равновесии все три фазы вещества - твердая, жидкая и парообразная. [28]
Все эти величины могут быть найдены по диаграмме состояния вещества. [29]
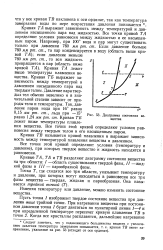 |
Диаграмма состояния вещества. [30] |
Страницы: 1 2 3 4