Диаграмма - состояние - вещество
Cтраница 3
Кривые ТА, Т Б и ТВ разделяют диаграмму состояния вещества на три области: / - область существования твердой фазы, / / - жидкой фазы и / / / - парообразной фазы. [31]
Для определения параметров состояния вещества в любых условиях имеются диаграммы состояния вещества. [32]
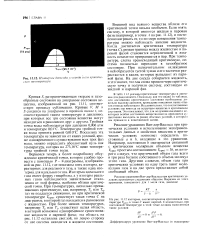 |
Иютермы диоксида углерода ii его критическая температура. [33] |
Кривая S, разграничивающая твердое и газообразные состояния на диаграмме состояния вещества, изображенной на рис. 11.11, соответствует процессу сублимации. Кривые V, М и S сходятся на диаграмме в тройной точке f, соответствующей таким температуре и давлению, при которых все три состояния вещества могут находиться в равновесии друг с другом. Тройная точка воды наблюдается при давлении 0 006 атм и температуре 0 01 С. Температура тройной точки воды принята равной 0 010 С. Поскольку эта температура не зависит ни от каких условий, кроме одновременного существования всех трех фаз воды, можно определить абсолютный нуль как температуру, которая на 273 16 С ниже температуры тройной точки воды. [34]
 |
Диаграмма состояния вещества. [35] |
Диаграммы, подобные изображенной на рис. 89.1, называются диаграммами состояния вещества. [36]
Температура плавления зависит от внешнего давления: для большинства веществ она несколько увеличивается с повышением давления, как это видно на диаграмме состояний вещества ( см. рис. 120), где кривая равновесия фаз AD имеет небольшой наклон вправо. Однако некоторые ( немногие) вещества, в том числе лед, чугун, висмут, сурьма, составляют исключение: у них температура плавления уменьшается с повышением давления. Повышение внешнего давления способствует уменьшению объема этих веществ, помогает плавлению, в результате чего температура плавления уменьшается. [37]
Температура плавления зависит от внешнего давления: для большинства веществ она несколько увеличивается с повышением давления, как это видно на диаграмме состояний вещества ( см. рис. 120), где кривая равновесия фаз AD имеет небольшой наклон вправо. [38]
Расчет критического расхода с помощью (1.1) выполняют либо методом последовательного приближения ( находят то значение критического давления, которое при заданных параметрах торможения дает максимум расхода смеси), либо графоаналитическим методом, построенным на использовании диаграмм состояния веществ в двухфазной области. [39]
Точке С соответствуют единственные для данного вещества значения р и Т, при которых все три фазы этого вещества могут находиться в равновесии. Точку С на диаграмме состояний вещества, которая изображает равновесие между всеми тремя фазами этого вещества, называют тройной точкой. [40]
Лишь сравнительно недавно многочисленные лаборатории начали проводить широкие исследования проблем генерации плазмы и преимуществ плазмохимических процессов, хотя плазма и ранее находила ограниченное применение для проведения в ней химических реакций, таких, как фиксация азота и синтез ацетилена. На рис. II 1.1 представлена диаграмма состояний веществ при высоких температурах, на основании которой можно сформулировать несколько важных для высокотемпературной химии положений. К нет молекул и могут существовать атомы только некоторых элементов, так как атомы и молекулы большинства веществ при этих температурах ионизированы. Таким образом, термин плазмохимия неудачен, поскольку при плазменных температурах нет молекул веществ. Но мы будем употреблять термин плазмохимия, понимая под ним химию, использующую высокие температуры и высокие энергии плазмы для реакций, проводимых при пониженных по сравнению с плазменными температурах, а также в тех случаях, когда большие скорости теплопередачи, достижимые в плазме, обычно вызывают изменение физических и химических свойств веществ. Графики температурной зависимости энтальпий некоторых одно - и двухатомных газов ( для равновесных условий при 1 атм) приведены на рис. III.2. Для диссоциации двухатомных молекул, происходящей в интервале температур от 4000 до 10 000 К, требуется от 90 до 200 ккал / моль, в то время как для ионизации, протекающей между 10000 и 30000 К, необходимо от 340 до 600 ккал. Максимальные температуры пламен достигают значений - 3000 К, при которых начинается процесс диссоциации молекул; в то же время минимальные температуры плазмы / - 10000 K, так как только при таких температурах достигается степень ионизации, достаточная для протекания тока, необходимого для поддержания плазмы. [41]
Если один из параметров системы является величиной постоянной, то переменных величин будет только две и точки, изображающие состояние системы, будут лежать на плоскости, пересекающей термодинамическую поверхность перпендикулярно к оси координат, на которой берется постоянная величина. Такие системы координат на плоскости называют диаграммами состояния вещества. Наиболее часто применяются диаграммы состояния с координатами р и v, р и Т, v и Т, дающие возможность наглядно проследить изменение состояния данной системы. [42]
Рассмотрим, в первую очередь, наиболее важные для структурной химии реконструктивные превращения. Вообще, изменение структуры и объема вещества всегда происходит вследствие термодинамических причин в соответствии с диаграммой состояния вещества. Однако кристаллохимия позволяет избежать запоминания многочисленных фактов, поскольку при повышении давления всегда увеличивается степень заполнения пространства, а уменьшение давления делает стабильной более рыхлую структуру. Поскольку рост КЧ приводит к более плотной упаковке атомов, реконструктивный ФП при высоком давлении всегда повышает координацию атомов. [43]
На рис. 14.4 схематически изображена такая диаграмма для вещества, когда в рассматриваемом пространстве, кроме этого вещества, ничего нет. Кривая КС есть уже известная нам зависимость давления насыщающего пара взятого вещества от температуры, где К - критическая точка, а точка С соответствует тем - 14.4. Диаграмма состояний вещества. Кривая СА выражает зависимость от температуры давления насыщающих паров, находящихся в равновесии с поверхностью твердого тела. Температура плавления вещества зависит от давления, на диаграмме линией ВС показана и эта зависимость. [44]
 |
Физико-химические свойства легкой и тяжелой воды. [45] |
Страницы: 1 2 3 4