Косовер
Cтраница 3
Аналогичные ЯМР-исследования Андерсона и Саймонса [5] дали им возможность построить свою шкалу акцепторной способности. На самом деле в ее основе лежит система Косовера с той лишь разницей, что образование и диссоциация ионной пары пиридиний - галогенид, отражающие влияние растворителя, изучаются не спектрофотометриче-ски, а методом ЯМР по величинам химических сдвигов протонов пиридинового кольца. Данные ЯМР позволяют различить 2 6 - и 3 5-про-тоны, а взаимодействие между галогенид-ионом и атомом азота пири-диния оказывает на эти пары протонов различное влияние. Таким образом, разница в величинах химических сдвигов этих двух типов протонов является мерой влияния растворителя. [31]
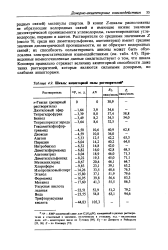 |
Шкалы акцепторной силы растворителей. [32] |
В конце Z-шкалы расположены не образующие водородных связей и имеющие низкие значения диэлектрической проницаемости углеводороды, галогенированные углеводороды, пиридин и ацетон. Приведенные немногочисленные данные свидетельствуют о том, что шкала Косовера правильно отражает величину акцепторной способности даже таких растворителей, которые являются сильными донорами, но слабыми акцепторами. [33]
Вг - Г - ( растворитель - ацетонитрил), причал это взаимодействие оказывает сильное влияние на нуклеофильность ионов ( гл. Исходя из отклонений от корреляции Z с другими электронными переходами, без участия I, Косовер [518] пришел к выводу, что 1 - образует комплексы с переносом заряда с ацетоном, ацетонитрилом и диметил-формамидом. [34]
Показывая двоякую зависимость эффектов растворителя ( от донор-ной и акцепторной способности), модель Майера тем самым объясняет, почему невозможно описать эффект растворителя в этих системах при помощи единственного эмпирического параметра. Например, очевидно, что стандартные величины AG растворения не могут обнаруживать линейной корреляции с параметрами, главным образом отражающими один тип эффекта, например с величиной Z Косовера или параметром Ет Рейхардта, с какой-либо одной из величин DN или AN или диэлектрической проницаемостью растворителя. Даже для систем, где один из эффектов доминирует настолько, что они могут быть описаны одним параметром, только расчеты, в которых принят во внимание и другой параметр, могут показать, оказывает ли последний влияние на результаты, и если оказывает, то в какой степени. [35]
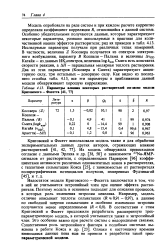 |
Параметры влияшш некоторых растворителей согласно модели Криговского - Фосетта. [36] |
Модель опробовали на ряде систем и при каждом расчете корректно определяли коэффициент корреляции R, относящийся к данной системе. Особенно убедительными получаются данные, которые характеризуют некоторые параметры, успешно используемые в практике для количественной оценки эффектов растворителя; ряд их приведен в табл. 4.13. Исследуемые параметры получали при различных типах измерений. В частности, величина Z Косовера получается из спектров электронного возбуждения, параметр В Коппеля - Пальма и величины AVQD Кагайя - из данных ИКчшектров, величина log / сион Смита есть константа скорости реакции, а АН - парциальная молярная теплота растворения. Два из этих параметров ( Косовера и Смита) характеризуют акцепторную силу, три остальных - донорную силу. Как видно из последнего столбца табл. 4.13, все эти параметры в приближении данной модели обнаруживают хорошую корреляцию. [37]
Чем менее полярен растворитель, тем больше смещено равновесие вправо в первом случае и изменено электронное состояние молекулы в сторону менее полярной возбужденной формы во втором случае. В результате этих изменений происходит углубление цвета. На основании определения положения максимумов поглощения в УФ-спектрах Косовер, а также Димрот и Райхардт предложили свои шкалы параметров полярности растворителей: Z и Ет соответственно. [38]
Это значение оказалось значительно ниже ( в ряде случаев в 103 раз) в некоторых водно-органических смесях растворителей. В исследованном диапазоне gkK имеет линейную корреляцию с Z-параметрами Косовера, которые являются эмпирической мерой полярности растворителя. Это указывает на то, что лимитирующая стадия в диспропорционировании катион-радикала семитионина - это скорее перенос электрона с последующим переносом протона [ реакции ( 2 - 35) - ( 2 - 37) ], а не перенос Н - атома. [39]
Полученные им величины Q находятся в линейной зависимости от величин Косовера [ см. Е. М. К о s о w e r, J. [40]
Полученные им величины Я находятся в линейной зависимости от величин Косовера [ см. Е. М. К о s о w e r, J. [41]
Косовер объяснил чувствительность полосы переноса заряда к природе растворителя, предположив, что переход сопровождается переворачиванием диполя. Предполагается, что в основном состоянии ион 1 - локализован над плоскостью пиридинового кольца вблизи N и, следовательно, суммарный диполь перпендикулярен плоскости. Сильное взаимодействие этого диполя с окружающими молекулами растворителя приводит к их ориентации ( Косовер назвал эту совокупность ориентированных молекул сиботактической областью) и отсюда к стабилизации основного состояния. При возбуждении отрицательный заряд перемещается к пиридиновому кольцу, заставляя диполь повернуться в плоскость кольца. При этом дипольный момент существенно уменьшается, хотя и не до нуля. По принципу Франка-Кондона за время возбуждения молекулы растворителя не успевают перестроиться и электростатическое взаимодействие между растворителем и растворенным веществом не успевает стабилизовать возбужденное состояние. [42]
Модель опробовали на ряде систем и при каждом расчете корректно определяли коэффициент корреляции R, относящийся к данной системе. Особенно убедительными получаются данные, которые характеризуют некоторые параметры, успешно используемые в практике для количественной оценки эффектов растворителя; ряд их приведен в табл. 4.13. Исследуемые параметры получали при различных типах измерений. В частности, величина Z Косовера получается из спектров электронного возбуждения, параметр В Коппеля - Пальма и величины AVQD Кагайя - из данных ИКчшектров, величина log / сион Смита есть константа скорости реакции, а АН - парциальная молярная теплота растворения. Два из этих параметров ( Косовера и Смита) характеризуют акцепторную силу, три остальных - донорную силу. Как видно из последнего столбца табл. 4.13, все эти параметры в приближении данной модели обнаруживают хорошую корреляцию. [43]
Таким образом, теория Кошланда рассматривает комплементарность как динамическое свойство активных центров фермента. По-видимому, при сближении субстрата с активным центром фермента вследствие их взаимного влияния происходит трансформация структуры обоих реагирующих молекул. Представления Кошланда помогают понять многие стороны механизма каталитического действия ферментов, отличие последних от небиологических катализаторов, а также механизм активации и ингибирования ферментов ( см. гл. Поэтому трудно согласиться со скептической оценкой, которую дает Косовер [8] теории Кошланда. [44]
В качестве модельной системы, для подтверждения правильности предложенной корреляции, Бронштейн использовал 1-этил - 4-карбоме-токсипиридинийиодид, ранее использованный Косовером. Поэтому он предположил, что его уравнение имеет большую общность и пригодно для описания зависимости от растворителя не только спектральных характеристик, но и любого определяемого экспериментально и зависящего от растворителя параметра. В действительности это справедливо лишь для систем, в которых зависимость от растворителя определяется лишь одним фактором, а другими можно пренебречь. Причина того, почему эта корреляция оказалась подходящей для описания величин Z Косовера, состоит в том, что спектральные сдвиги, служащие ее основой, главным образом определяются акцепторной способностью растворителя. [45]
Страницы: 1 2 3