Атака - нуклеофил
Cтраница 3
Из этих альтернативных механизмов основным является тип II, где атака нуклеофила по карбонильной группе не нуждается в помощи. X обладает большой электроотрицательностью), либо HY - очень хороший нуклеофил. Одновременная реализация обоих процессов в растворах невозможна, однако в тех случаях, когда реакция катализируются за счет адсорбции реагентов на поверхности ( например, для ферментативных превращений), в молекуле могут присутствовать как группа - донор протонов, так и группа - акцептор протонов, каждая из которых будет независимо катализировать свой процесс. [31]
 |
Константы образования трис-комплексов. [32] |
Двухзарядный катион способен хелатировать оба атома кислорода пирофосфата, облегчая атаку нуклеофила на атом фосфора. [33]
Если бы имел место механизм второго порядка, то отношение степени атаки нуклеофила по ( 3-водородупо сравнению с атакой на нейтральный. [34]
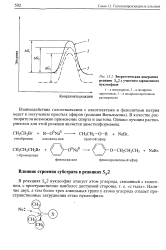
Преобладающий ( 1Л; 25) - диастереомер получается в результате атаки нуклеофила по карбонильной группе кетона со стороны, противоположной метальной группе при соседнем атоме углерода. Второй ( IS; 25) - диастереомер получается, когда метиллитий присоединяется с той же стороны, где расположена метальная группа при С-2. Очевидно, что это создает значительные стерические препятствия для присоединения нуклеофильного реагента, поэтому ( IS; 25) - диастереомер образуется в меньшем количестве. На рис. 16.2 приведены энергетические профили образования двух диастереомеров в результате нуклеофильного присоединения CHsLi к хиральному альдегиду. Исходное состояние для двух конкурирующих реакций характеризуется одинаковой энергией для ( и) - и ( 5) - энантиомеров альдегидов, тогда как переходные состояния диастереомерны и обладают поэтому различной энергией а, следовательно, различны по энергии. Это означает, что энергия активации для двух конкурирующих реакций также различна и два диастереомера - ( IR; IS) к ( IS; 25) - образуются в неравном количестве. [35]
Аналогичным образом заместители в бензоильной группе ос-бром-дезоксибензоина влияют на скорость реакции и в случае непосредственной атаки внешнего нуклеофила наос - углеродный атом. Например, при взаимодействии - бром-4 - Х - дезоксибензоинов с анилинами в этилцеллозольве ( см. табл. 4) электроноакцепторный заместитель, повышая электрофильность карбонильной группы, способствует, согласно модели Стрейтвизера, связывающему соседнему ообитальному перекрыванию и вызывает ускорение реакции вследствие понижения энтальпии активации при стабилизации переходного состояния. [36]
Согласно принципу микроскопической обратимости, реакция присоединения, обратная такому отщеплению, должна начинаться атакой нуклеофила, однако отдача протона начинается раньше того, как закончится образование карбаниона. [37]
Как известно, реакция Арбузова идет через ион квазифосфония, который; затем деалкилируется вследствие атаки нуклеофила. [38]
 |
Энергетическая диаграмма реакции SN2 с участием заряженного нуклеофила. [39] |
Наличие двух, а тем более трех алкильных групп у атома углерода создает пространственные затруднения атаке нуклеофила. [40]
Наиболее широко используются катион 1 3-оксазония 67, способный, аналогично катиону пиридиния, подвергаться атаке нуклеофилов, а также тетрагидро-1 3-оксазины 68, которые можно рассматривать как предшественники альдегидов. [41]
При переходе к хлориду Sjyl - процесс, как известно, затрудняется и становится более вероятной атака нуклеофила с тыла, как при 5лг2 - замещении. [42]
Для того чтобы определить, какая из них наиболее благоприятна для осуществления замещения по 5 2-механизму ( атака нуклеофила Nu с тыла), изобразим их в пространстве. [43]
Такая двойственность свойств приводит к тому, что ос р-непредельные альдегиды, кетоны и эфиры могут подвергаться атаке нуклеофила и по карбонильному атому углерода, и по р-углеродному атому. [44]
В настоящее время установлено, что замещение через переходное состояние типа ( I), т.е. с атакой нуклеофила с тыльной стороны по отношению к уходящей группе, является общим правилом для всех л - реакций независимо от их зарядного типа. Даже в тех случаях, когда в исходном субстрате на уходящей группе имеется положительный заряд, а нуклеофил заряжен отрицательно, и из электростатических соображений фронтальная атака через переходное состояние типа ( II), казалось бы, должна быть более предпочтительной, реакция все равно происходит с инверсией конфигурации. Это легко проиллюстрировать следующим примером. [45]
Страницы: 1 2 3 4