Атака - радикал
Cтраница 1
Атака радикала на углерод ароматического кольца сопровождается значительным перераспределением электронной плотности ароматических и гетероциклических молекул. В связи с этим строение соединений, в том числе и природа заместителя, сильно влияет на скорости замещения. [1]
При атаке тгаретга-бутоксильных радикалов [56] и при распаде терете-бутиловых эфиров циклоалканкарбоновых кислот [18] получают ряд С-3 С-4 С-5 С-6 С-7 С-8 с довольно небольшими различиями между отдельными циклами. [2]
По-видимому, атака радикала SH приводит к аксиальной SH-группе и экваториальному хлору. Образования г ис-продукта следует ожидать в том случае, если атака H2S произойдет раньше, чем конформационный переход, который дает более устойчивое экваториальное расположение SH. Продукт может образоваться из радикала с экваториальным SH и экваториальным хлором. [3]
В процессе атаки радикала ОН атомом О образуется активированный комплекс без нарушения правила Вигнера. Из общих соображений ( поскольку это - реакция двух активных частиц) ясно, что энергия активации Ез равна нулю или, по крайней мере, невелика. Комплекс имеет очень рыхлую структуру, и оба радикала не утрачивают своей индивидуальности, а радикал ОН сохраняет угловой момент. Силы взаимодействия хорошо описываются потенциалом Лен-нарда - Джонса 6 - 12 ( см. гл. [4]
Y затрудняет атаку радикала на О - Н связь. В реакциях жидкофазно-го окисления такая водородная связь тормозит отрыв атома Н перекисным радикалом от О - Н связи гидроперекиси, спирта, кислоты, фенола и N - Н связи ароматического амина. [5]
Фактически же вся проблема об атаке радикалов на ароматические системы в настоящее время является невыясненным разделом химии радикалов. [6]
Начальная стадия гемолитического ароматического замещения включает атаку радикала на субстрат, приводящую к образованию радикал-аддукта. [7]
В преобладающем количестве образуется изомер в результате атаки радикала, являющегося переносчиком цепи, на монофтори-рованный атом углерода. Таким образом, в реакции присоединения трифторметантиола соединение 60 получается в преобладающем количестве. [8]
Направление присоединения можно всегда предсказать, используя правило: атака радикала направлена на наименее замещенный атом двойной связи. [9]
 |
Скорость реакции присоединения гидрида триэтилолова к стиролу. [10] |
Присоединение оловоорганических гидридов к олефинам начинается, по-видимому, с атаки радикала R, образующегося при распаде катализатора, на молекулу оловоорганического гидрида. В результате в реакционной смеси появляется триалкилстаннильный радикал. [11]
Строение нитрохлоралкана обычно может быть предсказано на основании предположения, что атака радикала - N02 направлена на наименее замещенный атом углерода при двойной связи с последующим переносом цепи с помощью нитрилхлорида. Однако могут образоваться и другие продукты, по-видимому, в результате начальной атаки атома хлора с последующим переносом на нитрил-хлорид. Так, например, строение продуктов реакции, полученных из стирола [379] и из коричной кислоты [379], а именно а-нитро-р-хлорэтилбензола и а-хлор - 3-нитро-р - феншгаропионовой кислоты, можно объяснить на основании предположения, что именно такой механизм является преобладающим. По-видимому, необходимо более тщательное изучение такой возможности, особенно принимая во внимание важное значение аналогичного цепного механизма в реакциях присоединения сульфенилгалогенидов ( см. стр. [12]
Строение питрохлоралкапа обычно может быть предсказано на основании предположения, что атака радикала - NO2 направлена на наименее замещенный атом углерода при двойной связи с последующим переносом цепи с помощью нитрил хлорида. Однако могут образоваться и другие продукты, по-видимому, в результате начальной атаки атома хлора с последующим переносом на нитрил-хлорид. Так, например, строение продуктов реакции, полученных из стирола [379] и из коричной кислоты [ 379J, а именно сс-нитро - Р - хлорэтилбепзола и а-хлор-р-нитро - р-фенилпропионовой кислоты, можно объяснить на основании предположения, что именно такой механизм является преобладающим. По-видимому, необходимо более тщательное изучение такой возможности, особенно принимая во внимание важное значение аналогичного ценного механизма реакциях присоединения сульфенилгалогепидов ( см. стр. [13]
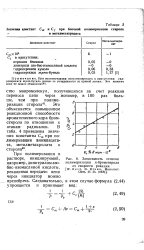 |
Зависимость степени полимеризации я-бромстирола. [14] |
Это объясняется повышением реакционной способности ароматического ядра бром-стирола по отношению к атакам радикалов. [15]
Страницы: 1 2 3