Атом - щелочной металл
Cтраница 2
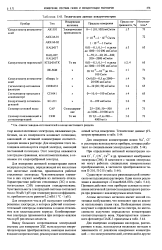 |
Технические данные кондуктометров. [16] |
Атомы щелочных металлов имеют низкий потенциал возбуждения, что позволяет при их анализе использовать пламя газа. Возбужденные атомы излучают в определенной части спектра, по интенсивности излучения определяется концентрация соответствующего иона. [17]
Атомы щелочного металла при взаимодействии с водой образуют атомарный водород. В связи с этим предполагается [4], что платиновый электрод в щелочных растворах функционирует как электрод щелочного металла. Возможно, что третий максимум на /, ф-кривых связан с десорбцией атомов щелочного металла. [18]
Такие атомы щелочных металлов также оказывают каталитическое действие на реакции серы с углеродом [661], тогда как другие неорганические атомы, иногда встречающиеся в золе углеродов, могут способствовать окислению [1015] ( ср. [19]
Для атомов щелочных металлов расчеты дисперсионной энергии в приближении Хартри - Фока могут претендовать лишь на правильный порядок величины. [20]
Спектры атомов щелочных металлов, обладающих одним внешним ( оптическим) электроном сверх заполненных оболочек похожи на спектр атома водорода, но смещены в область меньших частот. Кроме того, величины nk и пт в этом случае отличаются от целых чисел, хотя для каждого атома продолжают иметь вполне определенные дискретные значения. У атомов с двумя внешними электронами число спектральных серий увеличивается и структура их делается более сложной. Особенно показательны в этом отношении спектры атомов с достраивающимися / - и d - оболочками. [21]
У атомов щелочных металлов атомный остаток не обладает магнитным моментом, так как в него входит четное число электронов с попарно скомпенсированными магнитными моментами. Спины электронов попарно антипараллельны друг другу. У гелия, кроме электрона, совершающего переходы, сопровождаемые испусканием оптического спектра, имеется еще один электрон, магнитный момент которого и играет существенную роль. [22]
Спектры атомов щелочных металлов, обладающих одним внешним ( оптическим) электроном сверх заполненных оболочек, схожи со спектром атома водорода, но смещены в область меньших частот. Спектры еще усложняются для атомов, обладающих тремя и более внешними электронами. Особенно сложны спектры атомов с достраивающимися d - оболоч-ками ( напр. Fe) и / - оболочками, состоящие из сотен и тысяч линий. Истолкование спектров многоэлектронных атомов представляет трудную задачу, к-рая решается на основе квантовой теории строения атома. [23]
Термы атомов щелочных металлов, как следует из анализа тонкой структуры их спектров, представляют собой дублеты, за исключением 5-термов, которые являются синглетами. Можно ли сделать заключение о синглетности именно 5-термов из того факта, что величина расщепления ( в волновых числах) спектральных линий резкой серии одинакова, в то время как для линий главной серии не одинакова. [24]
Спектры атомов щелочных металлов, имеющих один электрон на внеш. Зх, Переходу этого электрона из состояния Зр в состояние Зз соответствует желтая линия Ыа ( дублет X 589 0 им и X 589 6 нм); это-наиб. [25]
Реакции атомов щелочных металлов ( М) в матрицах наиболее широко изучены. [26]
Спектры атомов щелочных металлов и металлов подгруппы меди ( Li, Na, К, Rb, Cs, Cu, Ag, Аи) довольно простые и хорошо иллюстрируют отмеченные выше эффекты, в частности сильное расщепление линий. [27]
У атомов щелочных металлов - лития, натрия, калил, рубидия и цезия - внешний электронный слой состоит только из одного электрона. Атом легко отдает этот электрон и превращается в положительно заряженный ион. Именно поэтому щелочные металлы так легко вступают в химическую реакцию. [28]
Ионизация атомов щелочных металлов медленными электронами / / Журн. [29]
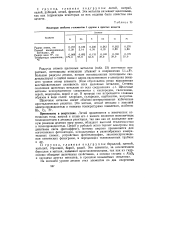 |
Некоторые свойства s - элементов I группы и простых веществ. [30] |
Страницы: 1 2 3 4