Атом - рений
Cтраница 3
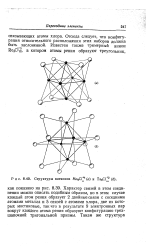 |
Структуры катионов Мо6С1 4 ( а и TaeCl 2 ( б. [31] |
Характер связей в этом соединении можно описать подобным образом, но в этом случае каждый атом рения образует 2 двойные связи с соседними атомами металла и 5 связей с атомами хлора, две из которых мостиковые, так что в результате 9 электронных пар вокруг каждого атома рения образуют конфигурацию трех-шапочной тригональной призмы. [32]
Каждый атом рения координирован тремя атомами хлора, одним атомом фосфора триэтилфос-финовой группы и вторым атомом рения, располагающимся по вершинам искаженной тетрагональной пирамиды. В димере имеется прочная связь Re-Re длиной в 2 222 А. Это расстояние близко к найденному ранее в Re2 ( O2CC6H5) 4Cl2 - 2CHCl3 ( реф. Атомы С1 ( 2) и С1 ( 3) в транс-позиции друг к Другу находятся на расстоянии 2 294 и 2 299 А от рения, третий атом хлора расположен в траке-позиции к фосфору на расстоянии 2 352 А. Авторы полагают, что это различие является следствием транс-эффекта фосфинового лиган-да. [33]
 |
Структура Мп2 ( СО10. [34] |
Кроме прямого вклада внешних электрических зарядов в градиент поля, большую роль играет непрямое влияние поляризации атомного остова атома рения ( или марганца) этими внешними зарядами. [35]
Различие в длинах связей Re-N ( 1 53 и 2 44 А) настолько велико, что координационный полиэдр атома рения естественнее описать как тетрагональную пирамиду, а не как октаэдр. [36]
Эти первые положительные результаты, указывающие на существование комплексных катионов с рением во внутренней сфере, позволяют надеяться, что атом рения является хорошим комплексо-образователем и может дать многообразные соединения. [37]
Естественно предположить, что атомы водорода находятся, как это показано на рис. 80 а, между наиболее удаленными друг от друга атомами рения. [38]
Структура Re3H ( CO) i4 показана на рис. 3 - 22; в ней имеется мостик Re - Н - Re, а третий атом рения выступает в роли простого лиганда. Для ResH ( CO) u сигнал от гидрид-иона наблюдается при т 26 25, а в ИК-спектре наблюдаются только колебания концевых карбонильных групп. [39]
Повышенная стабильность производных карбонила рения по сравнению с марганецсодержащими соединениями, вероятно, обусловлена большей возможностью перекрывания гибридизованных /) 2-орбиталей атома углерода с атомными орбиталями атома рения чем с орбиталями атома марганца. [40]
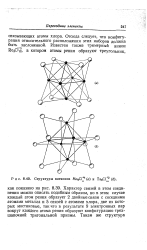 |
Структуры катионов Мо6С1 4 ( а и TaeCl 2 ( б. [41] |
Характер связей в этом соединении можно описать подобным образом, но в этом случае каждый атом рения образует 2 двойные связи с соседними атомами металла и 5 связей с атомами хлора, две из которых мостиковые, так что в результате 9 электронных пар вокруг каждого атома рения образуют конфигурацию трех-шапочной тригональной призмы. [42]
Дипольные моменты комплексов КеН [ Р ( СбН5) 3 ] 3 - [ ( СН3СО) 2СН ] Х [247] находятся в пределах, рассчитанных для пентагональной бипирамиды ( 5 47D для X С1); однако, если принять во внимание большой стерический объем трифенилфос-фина и наличие других лигандов, координированных при атоме рения, более правдоподобна искаженная структура, в которой расположение лигандов в значительной степени определяется отталкиванием несвязанных групп. [43]
В основании тетрагональной пирамиды лежат четыре атома брома, ее вершину занимает атом кислорода; атом азота нитрильной группы дополняет ее до октаэдра. Атом рения смещен из плоскости четырех атомов брома на 0 34А в сторону вершины пирамиды. Сильное л-взаимодействие атомов О и Re подтверждается магнитными свойствами и данными по ИК-спектру. [44]
Атом рения расположен на оси симметрии второго порядка. В плоскости, перпендикулярной этой оси, в транс-положении друг к другу размещаются два атома хлора и два атома фосфора дифенилфосфиновых групп; на оси симметрии в транс-положении друг к другу находятся атом азота метоксифенилими-на и третий атом хлора. [45]
Страницы: 1 2 3 4