Атом - сера
Cтраница 1
Атом серы, обладающий рыхлой, легко поляризуемой электронной оболочкой, менее электроотрицателен, чем атом кислорода. Поэтому тиолы не склонны к образованию водородных связей в отличие от спиртов. Они практически не образуют ассоциатов. Этим объясняются их более низкие температуры кипения и худшая растворимость в воде. [1]
Атом серы может совсем изменить направление течения реакции. Так, при хлорировании дибензтиофена при низкой температуре хлор не замещает атомов водорода в ядре, а присоединяется к атому серы. Атом серы легко окисляется до сульфоксида или сульфона. Сульфо-ксидная и сульфоновая группы оказывают направляющее влияние при вхождении замещающих групп, ориентируя их в положение 3 в бензтиофеновом ядре и в положения 3, 6 в дибензтиофеновом ядре. Сульфоны и сульфоксиды гомологов дибензтиофена приобрели за последнее время большое научное значение при доказательстве строения соединений этого класса. [2]
Атом серы в тиоэфирах способен более или менее легко присоединять хлор, бром или иод. Обычно такие продукта присоединения, типа R. При действии воды многие из этих дихлор - и дибромпроизводных превращаются в сульфоксиды. [3]
Атомы серы в персульфид-ионе связаны между собой ковалентной связью. В кристалле пирита, который до некоторой степени можно рассматривать как аналог кристалла поваренной соли NaCl, атомы железа занимают позиции натрия, а позиции хлора заняты гантелью из атомов серы. [4]
Атом серы может совсем изменить направление течения реакции. Так, при хлорировании дибензтиофена при низкой температуре хлор не замещает атомов водорода в ядре, а присоединяется к атому серы. Атом серы легко окисляется до сульфоксида или сульфона. Сульфо-ксидная и сульфоновая группы оказывают направляющее влияние при вхождении замещающих групп, ориентируя их в положение 3 в бензтиофеновом ядре и в положения 3, 6 в дибензтиофеновом ядре. Сульфоны и сульфоксиды гомологов дибензтиофена приобрели за последнее время большое научное значение при доказательстве строения соединений этого класса. [5]
Атом серы, имеющий четыре устойчивые внешние орбитали и шесть внешних электронов, может образовать одинарные ковалентные связи с двумя другими атомами. [6]
Атом серы в тиофене имеет неподеленную пару р-электронов, сопряженную с двойной связью С С; в этом отношении тиофен аналогичен пирролу и фурану. Однако такое представление об электронном строении тиофена было бы неполным, так как атом серы, в отличие от атомов углерода, азота и кислорода, имеет во внешней электронной оболочке вакантную d - орбиту и поэтому может выступать в качестве акцептора электронов. Энергия резонанса в тиофене ( в настоящее время эту величину принимают равной 29 1 ккал [73]), больше энергии резонанса в фуране ( 16 2 ккал [73]), но резонансный дипольный момент тиофена меньше, чем фурана. [7]
 |
Корреляция дипольных моментов / г-замещенных диметиланили-нов а - - константами заместителей. [8] |
Атом серы может участвовать в двоякого рода электронном взаимодействии с я-системой ароматического кольца. Наиболее типичен для серы электронодонорный эффект, обусловленный включением заполненных Зр-орбиталей серы в общую я-систему. [9]
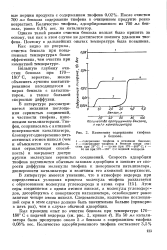 |
Изменение содержания тиофена в бензоле. [10] |
Атом серы соединяется с одним атомом никеля, а молекулы углеводорг-дов, десорбируясь с поверхности катализатора, освобождают ранее занятые четыре атома никеля. Следовательно, количество поглощенной серы в этом случае должно быть значительно больше ( примерно в пять раз), чем в случае обычной адсорбции. [11]
Атом серы как элемент III периода обладает высокой поляризуемостью, поэтому диполярная донорно-акцепторная связь S - О с положительным зарядом на сере должна быть значительно короче простой одинарной связи S-О. Величина диполъного момента как функция длины связи не позволяет сделать выбор между двумя этими структурами. [12]
Атом серы в серном ангидриде несет на себе дробный положительный заряд вследствие сильного электроноакцепторного воздействия трех атомов кислорода, что сообщает молекуле серного ангидрида свойства кислоты Льюиса. [13]
 |
Схема молекулы хлористого магния. [14] |
Атом серы имеет 6 внешних электронов. [15]
Страницы: 1 2 3 4