Разделенный атом
Cтраница 2
АА ( причем ch - теплота образования связи СН из разделенных атомов углерода и водорода; hk - теплота расщепления молекулы водорода); р15 иг, va - теплоты образования из атомов соответственно одинарной, двойной и тройной связей СС; х, у, z - число этих связей в молекуле углеводорода. [16]
Энергия Е4 первого состояния меньше, чем у диссоциированной молекулы ( разделенные атомы водорода), и поэтому атомы в нем связаны. Состояние же с энергией Ez соответствует отталкиванию двух атомов ( см. фиг. [17]
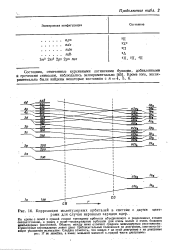 |
Корреляция молекулярных орбнталей в системе с двумя цент -. рамн для случая неравных зарядов. ядер.. [18] |
По краям с левой и правой сторон приведены орбнталн объединенного и разделенных атомов соответственно, а рядом с ними-молекулярные орбнталн для очень малых и очень больших межъядериых расстояний. Область между ними отвечает средним межъядерным расстояниям - Пунктирные вертикальные лнннн дают приблизительные положения на диаграмме, соответствующие указанным молекулам. Следует отметить, что шкала г иа этой диаграмме и иа диаграмме рис. 17 не линейна, а имеет меньший масштаб в правой части диаграммы. [19]
Когда ядра находятся весьма далеко друг от друга, молекула приближается к состоянию разделенного атома, и квантовые числа п и I не могут быть определены так, как это делалось выше. [20]
Тогда как основная идея метода МО ЛКАО состоит в переходе от атомных орбиталей разделенных атомов к молекулярным орбиталям молекулы в соответствии с симметрией задач и принципом Паули, возможен и другой подход. [21]
Впервые построенные в начале 30 - х годов Гундом и Малликеном [8] двухатомные корреляционные диаграммы разделенные атомы - объединенный атом сыграли важную роль в теоретической химии. Такие диаграммы представляют процесс сближения двух атомов из бесконечности. Справа располагают энергетические уровни разделенных атомов в порядке увеличения энергии. [22]
Иногда за нуль принимают энергию, которой обладают изолированные атомы системы, и большие значения г соответствуют состоянию с разделенными атомами. В таком случае имеются два минимума потенциальной энергии, так как и реагенты и продукты более стабильны, чем разделенные атомы ( фиг. [23]
Из уравнений (3.19.8), (3.19.9) и (3.19.10) получается третий столбец табл. 3.19.1, задающий связь между молекулярными состояниями и состояниями разделенных атомов. [24]
До сих пор мы рассматривали связи, образованные электронными парами, причем все эти связи были образованы либо из s - орбиталей разделенных атомов ( ненаправленных орбиталей), либо из соответствующих компонент р-орбиталей, или гибридных орбиталей, направленных вдоль направления связи. [25]
 |
Строение молекулы фосфорного ангидрида. а - структурная формула, б - пространственная конфигурация. [26] |
Свободные валентности этих атомов фосфора после присоединения к каждому из них по одному неразделенному атому кислорода могут быть затрачены либо на сцепление их через посредство разделенных атомов кислорода друг с другом, либо же на присоединение, опять-таки через разделенные атомы кислорода, последующих атомов фосфора. [27]
Отличие состоит лишь в том, что из-за отсутствия симметрии относительно центра молекулы теряют смысл символы g и и и что энергии АО одинаковых типов у разделенных атомов различаются. На рис. 18 приведена такая условная диаграмма. [28]
В действительности порядок возрастания энергии МО зависит от межъядерного расстояния г. На корреляционной диаграмме ( рис. 3 - 22) в столбце F приведены состояния с большими значениями г ( разделенные атомы обсуждались в разд. Состояния, в которые они трансформируются при г - - 0 ( составной атом), показаны в столбце С. [30]
Страницы: 1 2 3 4
