Разделенный атом
Cтраница 4
Если энергия молекулярной орбиты ниже энергии соответствующего уровня разделенных атомов, то такая молекулярная орбита называется связывающей. Если энергия молекулярной орбиты равна энергии соответствующего уровня разделенных атомов, то такая молекулярная орбита называется несвязывающей. И, наконец, молекулярная орбита называется разрыхляющей, если ее энергия лежит выше энергии соответствующего уровня разделенных атомов; разрыхляющие орбиты обозначаются знаком, стоящим справа сверху у символа орбиты. [46]
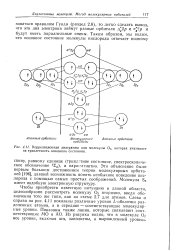 |
Корреляционная диаграмма для молекулы Оа, которая указывает на триплетность основного состояния. [47] |
Чтобы приобрести известную интуицию в данной области, целесообразно рассмотреть молекулу О2 вторично, введя обозначения того же типа, как на схеме 2.7 для атомов. Слева и справа на рис. 4.11 показаны различные уровни L-оболочки разделенных атомов, а в середине - соответствующие молекулярные уровни. Показаны также линии, которые связывают соответствующие МО и АО. Из рисунка видно, что в молекуле О. [48]
 |
Относительные ЛЫ И УВИДИМ как НУЖН выбирать функ-энергии молекулярных орби - Чии ФА И фв. [49] |
Молекулярная волновая функция г з соответствует увеличению электронной плотности в области между ядрами и сильному экранированию ядер друг от друга. В этом случае энергия системы будет понижена по сравнению с энергией разделенных атомов, так что образуется связь, которая описывается связывающей молекулярной орбиталью г и. Можно сказать, что эта молекулярная орбиталь образуется благодаря перекрыванию двух атомных орбиталей фд и фв. [50]
Согласно следствию VI из законов квантовой механики ( стр. Это легко сделать как для объединенного атома, так и для разделенных атомов. [51]
Рассмотрим, например, молекулу азота, которая имеет четырнадцать электронов. Эта молекула будет, вероятно, приближаться по своем поведению к разделенным атомам. Первые четыре электрона, невидимому, будут заполнять - оболочки ( п 1) двух атомов азота, а оставшиеся десять электронов - уровни 2з, г / з, жз и w - в указанном порядке. [52]
Эти два предельных случая называются соответственно разделенными атомами и объединенным атомом. При медленном изменении расстояния между протонами от R со до R 0 состояния разделенных атомов должны непрерывно переходить в состояния объединенного атома в соответствии с адиабатическим принципом. [53]
Волновая функция МО определяется по методу ЛКАО с использованием АО разделенных атомов. После значения А ( а л; или б) указывают главное и азимутальное квантовые числа для разделенных атомов. [54]
Все изменения, которые мы можем производить, заключаются в разделении прежде связанных атомов и в соединении прежде разделенных атомов. Какая неточность содержится в этом отрывке с современной точки зрения на атом. [55]
Иногда за нуль принимают энергию, которой обладают изолированные атомы системы, и большие значения г соответствуют состоянию с разделенными атомами. В таком случае имеются два минимума потенциальной энергии, так как и реагенты и продукты более стабильны, чем разделенные атомы ( фиг. [56]
Справа ( б и в) показаны два поперечных сечения потенциальной поверхности вдоль двух линий, параллельных оси у; сверху показано поперечное сечение вдоль линии, параллельной оси х, для больших значений у. Эти диаграммы поперечных сечений содержат кривые некоторых триплетных состояний ( они нанесены тонкими линиями), которые получаются из разделенных атомов. Поперечные сечения главных ( синглетных) потенциальных поверхностей нанесены жирными кривыми. [57]
В грубом приближении можно получить приблизительное расположение различных орбиталей по энергии из корреляции между объединенным атомом или молекулой и разделенными атомами почти таким же способом, как это была ранее описано для двухатомных и линейных многоатомных молекул. Следует однако, иметь в виду, что для каждого типа молекул корреляция будет иной. Рассмотрим в качестве примера нелинейную молекулу типа ХНз-На рис. 71 в крайней левой части схематически показаны энергии орбиталей объединенного атома, а в крайней правой части - разделенных атомов. [58]
Страницы: 1 2 3 4