Доля - активная молекула
Cтраница 1
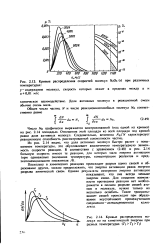 |
Кривые распределения скоростей молекул NzOs ( г при различных.| Кривые распределения молекул по их кинетической энергии при разных температурах ( 7з Тг Т. [1] |
Доля активных молекул в реакционной смеси обычно очень мала. [2]
Если доля активных молекул превышает 10 - 7, реакции идут практически мгновенно; если эта доля меньше 10 - 18, реакция практически не идет. [3]
При этом доля активных молекул остается: постоянной, число их оказывается пропорциональным концентрации и реакция идет по кинетическому уравнению первого порядка. Если время существования активных молекул мало, то большинство их распадается, не успев дезактивироваться. Скорссть активации пропорциональна числу двойных столкновений ( квадрату концентрации) и реакция идет по уравнению второго порядка. [4]
При повышении температуры доля активных молекул увеличивается за счет взаимного столкновения молекул. К подобным факторам относятся положительные и отрицательные катализаторы. Любой фактор, увеличивающий долю активных частиц по отношению к данному переходу системы или уменьшающий энергию активации этого перехода, действует как ускоритель последнего. [5]
Вероятностный фактрр и доля активных молекул. [6]
При комнатной температуре доля активных молекул составляет ничтожную величину, порядка 10 - 33, реакция практически не имеет места. С повышением температуры число активных молекул очень быстро увеличивается, чем и обусловлена зависимость скорости химической реакции от температуры. В рассматриваемом примере повышение температуры от 500 до Ш00 К приводит к увеличению числа активных молекул более чем в миллиард раз. [7]
Это число представляет собой долю активных молекул. [8]
Больцмана не нарушается реакцией и доля активных молекул остается постоянной, а реакция идет по типу реакций первого порядка. Если, наоборот, время существования активных молекул мало сравнительно со временем между соударениями, то большинство их распадается, не успев дезактивироваться. Тогда активация является наиболее медленной ступенью реакции; она пропорциональна числу двойных соударений, и реакция идет по типу реакций второго порядка. [9]
Простой расчет показывает, что доля активных молекул в значительной степени возрастает при повышении температуры. [10]
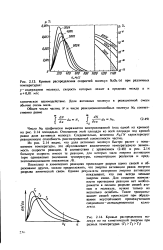 |
Кривые распределения скоростей молекул NzOs ( г при различных.| Кривые распределения молекул по их кинетической энергии при разных температурах ( 7з Тг Т. [11] |
Из рис. 2.14 видно, что доля активных молекул быстро растет с повышением температуры, это обусловливает аналогичную температурную зависимость скорости реакции. [12]
Эти пути сводятся либо к увеличению доли активных молекул ( например, в результате повышения температуры Т), либо к понижению самой энергии активации ( действие катализаторов и другие способы), либо, наконец, к увеличению общего числа соударений ( повышение концентрации); тогда, естественно, увеличится и число активных соударений, поскольку они при данных условиях реакции составляют определенную долю всех соударений. [13]
Площадь заштрихованного участка правее fia равна доле активных молекул без катализатора, площадь участка правее Е - доле активных молекул присутатвни катализатора. [14]
Таким образом, скорость мономолекулярных реакций зависит от доли активных молекул в реакторе. Последняя в свою очередь зависит от скорости активации и дезактивации молекул. Концентрация активных молекул в данных условиях поддерживается постоянной, соответствующей максвелл-больцмановскому распределению молекул по скорости и энергии и зависит от того, протекает или не протекает реакция. Когда реакция не протекает, число активных молекул пропорционально давлению ( концентрации), так как с изменением давления пропорционально изменяются скорости активации и дезактивации. Если протекает химическая реакция, концентрация активных частиц убывает в результате их распада на продукты реакции Тогда при установившемся процессе постоянство концентрации активных частиц А определяется уело: и м скорость активации равна сумме скоростей дезактивации и реакции. [15]
Страницы: 1 2 3 4