Доля - активная молекула
Cтраница 2
Значительное увеличение скорости химической реакции обусловлено быстрым ростом доли активных молекул с повышением температуры в связи с экспоненциальным характером этой зависимости. [16]
Отношение последней ко всей площади под кривой равно доле активных молекул. Следовательно, величина NKIN характеризует реакционную способность реагирующей совокупности частиц. [17]
Отношение ее ко всей площади под изотермой равно доле активных молекул. [18]
Отношение этой площади ко всей площади под кривой равно доле активных молекул. [19]
С увеличением концентрации веществ увеличивается общее число молекул, возрастает число их столкновений и доля активных молекул, что приводит к увеличению скорости реакции. [20]
При низких температурах число активных молекул ничтожно мало и скорость реакции мала; при нагревании доля активных молекул быстро увеличивается, что вызывает интенсивное ускорение химической реакции. Итак, скорость химической реакции определяется е числом общих столкновений в единицу времени, а числом столкновений активных молекул реагирующих веществ. [21]
При низких температурах число активных молекул ничтожно мало и скорость реакции мала; при нагревании доля активных молекул быстро возрастает, что вызывает интенсивное ускорение химической реакции. [22]
А - предэкспоненциальный множитель, а член e - EIRT, сильно зависящий от температуры, - доля активных молекул в реагирующей системе. Константа скорости реакции, таким образом, имеет структуру, она представляет произведение двух множителей, по-разному относящихся к изменению температуры. [23]
Площадь заштрихованного участка правее fia равна доле активных молекул без катализатора, площадь участка правее Е - доле активных молекул присутатвни катализатора. [24]
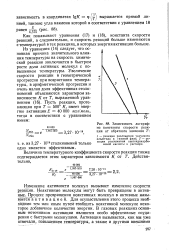 |
Зависимость логарифма константы скорости реак - 327 - Ю-18 ции от обратного значения Т. [25] |
Из уравнения ( 14) следует, что основная причина значительного влияния температуры на скорость химической реакции заключается в быстром росте доли активных молекул с повышением температуры. [26]
Увеличение скорости реакции под влиянием катализатора энергетически можно объяснить тем, что катализатор снижает энергию активации реакции, увеличивая тем самым долю активных молекул. Гомогенный катализ достаточно хорошо объясняется теорией промежуточных соединений, согласно которой катализатор, реагируя с исходным веществом, образует неустойчивое промежуточное соединение. [27]
Оба эти процесса поддерживают равновесную концентрацию активных молекул [ А ], соответствующую распределению Максвелла - Больцмана; В отсутствие химической реакции доля активных молекул не зависит от давления ( концентрации), а число их прямо пропорционально давлению ( концентрации), поскольку с изменением давления пропорционально изменяются и скорости активации, и скорость дезактивации. [28]
Почему скорость химического взаимодействия сильно возрастает с повышением температуры: а) из-за повышения средней кинетической энергии молекул; б) из-за увеличения доли активных молекул; в) из-за увеличения числа столкновений. [29]
Совершенно очевидно, что скорость реакции с повышением температуры так резко увеличивается не потому, что становится больше скорость движения молекул, а потому, что возрастает доля активных молекул. Следовательно, неактивные при данных условиях молекулы могут быть превращены в активные. [30]
Страницы: 1 2 3 4