Доля - активная молекула
Cтраница 3
Благодаря тому что с усложнением строения молекулы время жизни активного комплекса за счет перераспределения энергии столкновения по внутренним степеням свободы молекулы возрастает, скорость реакции оказывается пропорциональной не числу столкновений, а доле активных молекул в реагирующей системе, которая, в свою очередь, прямо пропорциональна общему числу реагирующих молекул. Поэтому выполняется кинетический закон лервого порядка. [31]
Благодаря тому, что с усложнением строения молекулы время жизни активного комплекса за счет перераспределения энергии столкновения по внутренним степеням свободы молекулы возрастает, скорость реакции оказывается пропорциональной не числу столкновений, а доле активных молекул в реагирующей системе, которая в свою очередь прямо пропорциональна общему числу реагирующих молекул. [32]
Последняя, как это ясно из рис. 10.4 и 10.6, определяется свойствами промежуточных соединений, образующихся в ходе реакции: чем меньше величина их свободной энергии ( G2 на рис. 10.4), тем больше доля активных молекул или других реагирующих частиц ( см. табл. 10.1), тем выше скорость реакции. [33]
Зависимость границы активной молекулы от вращательного момента необходимо учитывать прежде всего при вычислении константы скорости мономолекулярного распада в пределе низких давлений, где константа скорости в основном определяется числом столкновений в единицу времени, умноженным на долю активных молекул, образующихся при одном столкновении. [34]
В ходе химической реакции число активных молекул уменьшается, но в результате столкновений молекул реагирующих веществ происходит перераспределение энергии. Поэтому доля активных молекул NUKT / NO непрерывно восстанавливается и реакция не прекращается. [35]
Зависит ли доля активных молекул в системе от величины энергии активации. Как влияет величина энергии активации на скорость реакции. [36]
Более активными и способными к химическому воздействию окажутся и возбужденные молекулы, электроны которых в момент столкновения находятся на энергетических уровнях с большим запасом энергии. Но в общем доля активных молекул очень невелика. По этой причине очень мала и доля химически эффективных столкновений. При повышении температуры энергия вещества возрастает и перераспределяется мэжду молекулами таким образом, что значительно возрастает число активных молекул. В этом и заключается причина резкого действия температуры на скорость реакции. [37]
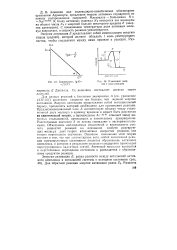 |
Зависимость lg К.| Изменение энергии в ходе реакции. [38] |
С повышением температуры доля активных молекул возрастает, и скорость реакции увеличивается. [39]
Число соударений, испытываемых одной молекулой в единицу времени, пропорционально давлению, следовательно, среднее время активации возрастает с понижением давления. В то же время доля активных молекул в равновесной системе не зависит от давления. Поэтому кинетические закономерности одной и той же мономолекулярной реакции различны в разных диапазонах изменения давления. [40]
Так же, как в случае газовых реакций, константа скорости мономолекулярных реакций в растворах зависит от числа колебательных степеней свободы ( внутренних колебаний) S. Если ERT, то доля активных молекул, а следовательно, и константа скорости реакции, падает с ростом числа степеней свободы внутренних колебаний. Однако с такими реакциями в кинетике почти не приходится встречаться. [41]
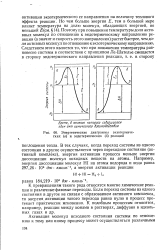 |
Энергетические диаграммы экзотермических ( а и эндотермических ( б реакций. [42] |
Но чем больше энергия Е, тем в большей мере влияет температура на долю молекул, обладающих энергией, не меньшей Е ( сы. Поэтому при повышении температуры доля активных молекул по отношению к эндотермическому направлению реакции ( а значит и скорость этого направления) растет быстрее, чем доля активных молекул по отношению к экзотермическому направлению. [43]
Оба эти процесса поддерживают равновесную концентрацию активных молекул [ А ], соответствующую распределению Максвелла - Больцмана. В отсутствие химической реакции доля активных молекул не зависит от давления ( концентрации), а число их прямо пропорционально давлению ( концентрации), поскольку с изменением давления пропорционально изменяются и скорости активации, и скорость дезактивации. [44]
Скорость электрохимических реакций, как и химических, может быть увеличена повышением температуры и применением катализатора. При повышении температуры растет доля активных молекул, при применении катализатора снижается энергия активации. [45]
Страницы: 1 2 3 4