Частная поляризационная кривая
Cтраница 1
Частные поляризационные кривые для кристаллизующихся фаз ( а не для компонентов) позволили сравнить потенциалы разряда этих фаз в сопоставлении с мйкрогеометрией катода: а - Со менее отрицателен, чем туфаза, и кристаллизуется в межъячеистых углублениях, где потенциал менее отрицателен, чем на вер - - шинах ячеек. [1]
Катодные частные поляризационные кривые характеризуются быстрым достижением потенциалов выделения водорода. При анодной поляризации уже при незначительных плотностях тока вследствие образования пассивных окисных пленок устанавливаются благородные потенциалы. Потенциалы изменяются пропорционально приложенному извне напряжению. [2]
Совпадение расчетных и экспериментальных частных поляризационных кривых указывает на соблюдение ПНПСР и ПСПК, а расхождение между ними - на существование отклонений от этих принципов. [3]
 |
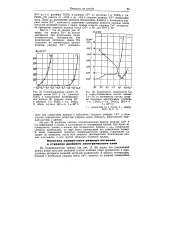
Зависимость выхода по току от плотности тока при выделении галлия на катоде из растворов 0 1 - н. NaGa02 1 - н. NaOH при 70 С. [4] |
Суммарная и частные поляризационные кривые разряда на катоде анионов галлия и катионов водорода. [5]
Уравнения для частных поляризационных кривых при постоянных значениях QOX и aRed в координатах Е - lg г являются прямыми линиями. По координатам точки пересечения прямых могут быть определены логарифмы плотности тока обмена и равновесный потенциал. Такой способ определения i0 и Ер часто применяется, так как не на всех электродах можно непосредственно намерить равновесный потенциал. Это связано с тем, что многие из электродов ( Fe, Ni в растворах собственных ионов), а также некоторые окислительно-восстановительные электроды, имеют низкие токи обмена. В равновесных условиях на основную реакцию обмена накладываются побочные процессы, которые возникают в результате присутствия примесей на металле ( окислы) или в растворе. Возможно также протекание неравновесных коррозионных процессов. Результатом является смещение измеряемого потенциала от равновесного потенциала основной реакции. Кроме того, при низких токах обмена равновесие устанавливается медленно. [6]
Из анализа частных поляризационных кривых, построенных для реальных кристаллизующихся фаз ( а не для компонентов), следует, что ионы Со разряжаются на поверхности твердого раствора Zn в а - Со со сверхполяриэацией 300 - 350 MS в сравнении с разрядом на чнстом Со. Потенциалы разряда фаз5 сопоставлены с микрогеометрией катода: а - Со менее отрицателен, чем 72-фаза и кристаллизуется в межъячеистых углублениях-где потенциал менее отрицателен, чем на вершинах ячеек. Увеличение содержания Со в осадках происходят вследствие-увеличения относительной доли высококобальтовой фазы. [7]
В то же время частные поляризационные кривые, вычисленные по уравнению ( 4) и имеющие наклон приблизительно 60 мв ( для Р 0 5), с ростом заполнения ( до 0 0 5) сдвигаются в сторону меньших перенапряжений. Так как скорость реакции при малых заполнениях 0 определяется адсорбированными ионами гидроксила, обладающими более сильным каталитическим действием, то положительный катализ галоидными ионами, который следовало бы ожидать, до сих пор не удавалось наблюдать. [8]
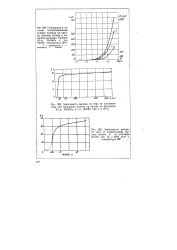
На рис. 38 показаны частная поляризационная кривая разряда Со2 и его содержание в осадке в зависимости от поляризации катода. Как видно из приведенных данных в начале, при потенциалах, блдаких к срсо:, содержание кобальта преобладает, по мере роста поляризации его содержание падает. В точке, отвечающей перелому поляризационной кривой, содержание Со падает до минимума, после чего начинает увеличиваться. Аналогичные данные получаются и для друшх металлов железной группы. [10]
Это подтверждается данными, полученными построением частных поляризационных кривых посредством определения выходов по току для галлия и водорода в ряде опытов электролиза ( рис. 254), проводимых при соблюдении постоянства заданного потенциала ( см. гл. [11]
Поэтому точные исследования целесообразнее производить посредством построения реальных частных поляризационных кривых по данным опытов электролиза, проводимых при строго соблюдаемых потенциалах для каждого опыта. [12]
 |
Полная кривая катодной. [13] |
Это О бстоятельство имеет значение при построении суммарной поляризационной кривой для кислородного электрода из частных поляризационных кривых, соответствующих замедленной диффузии и реакции перехода. [14]
Для изучения кинетики металлургических реакций применен метод диаграмм плотность тока - потенциал с использованием частных поляризационных кривых и измерением стационарных потенциалов. Аналитическое описание диаграммы позволяет получить уравнения скоростей изучаемых процессов. [15]
Страницы: 1 2 3