Кольцевой атом - азот
Cтраница 1
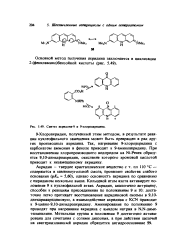 |
Синтез акридона-9 и 9-хлороакридина. [1] |
Кольцевой атом азота активирует положение 9 к нуклеофильной атаке. Акридин, аналогично антрацену, способен к реакциям присоединения по положениям 9 и 10: достаточно легко протекает восстановление акридиновой сисемы в 9 10-дигидриакридиновую, а взаимодействие акридина с KCN приводит к 9-циано - 9 10-дигидроакридину. Аминирование по положению 9 проводят при нагревании акридина с амидом натрия в N. [2]
 |
Синтез адеиииа из цианида водорода. [3] |
Кольцевые атомы азота пиримидина проявляют нуклеофильные свойства и могут быть алкилированы, например, метилиодидом. Производные пиримидина с электронодонорными заместителями способны образовывать N-ацилпроизводные. [4]
Незамещенные у кольцевых атомов азота имидазолы и пиразолы реагируют с активными металлами или их производными подобно соответствующим пирролам, однако в отличие от последних ( см. стр. [5]
Незамещенным по кольцевым атомам азота имидазолам свойственны таутомер-ные превращения, которые становятся очевидными в случае несимметрично замещенных производных, таких, как, например, показанный ниже метилими-дазол. Эта индивидуальная особенность химии имидазола означает, что назвать это соединение просто 4-метилимидазол было бы ошибочным, так как его молекула находится в таутомерном равновесии с 5-метилимидазолом и практически неразделима с ним. Все подобные таутомерные пары неразделимы, поэтому условились называть их, например, 4 ( 5) - метилимидазол. [6]
В этих условиях кольцевой атом азота также алкилируется, но гидроксильная группа реагирует быстрее. Однако в некоторых случаях получаются неудовлетворительные результаты, возможно, в связи с тем, что алкилируются по азоту бетаинные формы. [7]
В этих условиях кольцевой атом азота также алкилируется, но гидроксильная группа реагирует быстрее. Диазометан и диазоэтан алкилируют феноль. Однако в некоторых случаях получаются неудовлетворительные результаты, возможно, в связи с тем, что алкилируются по азоту бетаинные формы. [8]
Устойчивость к окислению кольцевого атома азота, находящегося по соседству с атомом кислорода в гетероциклических соединениях, по-видимому, является общим правилом. [9]
Образование четвертичных солей по кольцевому атому азота должно было бы повышать основность акридиновых соединений, но вследствие таутомерных изменений, которым подвергаются четвертичные акридины ( стр. [10]
Образование четвертичных солей по кольцевому атому азота должно было бы повышать основность акридиновых соединений, но вследствие таутомерных изменений, которым подвергаются четвертичные акридины ( стр. [11]
Элиминированию цианид-иона при таком механизме препятствует протонизация кольцевого атома азота, и промежуточные продукты могут стабилизироваться протонизацией атомов С и N нит-рильной группы с образованием в конечном счете амина. В промежуточной области рН, где равновесная концентрация протониро-ванных частиц мала и первая волна является кинетической или квазидиффузионной, механизм процесса зависит от потенциала электрода. [12]
Степень дезактивации пиридинового цикла по отношению к электрофильным реагентам в результате оттягивания электронов кольцевым атомом азота хорошо видна из того, что до сих пор еще не удалось ввести пиридин в реакции, подобные реакции Фриделя - Крафтса. [13]
Несмотря на то, что аминоакридины, как правило, присоединяют первый протон к кольцевому атому азота, иногда в силу пространственных факторов аминогруппа ионизируется первой. [14]
За редкими исключениями гетероароматические оксипроизводные, содержащие оксигруппу в ос - или у-положенин к кольцевому атому азота, существуют преимущественно в оксо-форме. Данные ИК-спектров ( по этому вопросу) рассматриваются в основном в разделах, посвященных соединениям, содержащим карбонильные группы в кольце. Шейнкер и Померанцев [805] пришли к аналогичным выводам. [15]
Страницы: 1 2 3