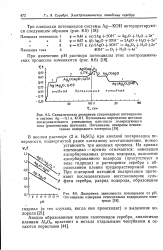
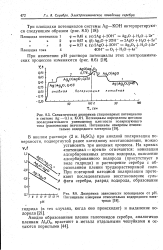
Адсорбированный атом - водород
Cтраница 2
Электрохимические процессы образования или удаления адсорбированных атомов водорода п кислорода сильно сокращают или полностью ликвидируют область идеальной поляризуемости на электродах из переходных металлов. Поэтому в подавляющем большинстве случаев метод измерения емкости используется для изучения адсорбции органических веществ на электродах из s, р-металлов. [16]
При одновременном разряде водородных ионов образующиеся адсорбированные атомы водорода внедряются в растущий осадок металла. Это изменяет механические свойства металла появляется так называемая водородная хрупкость. Данное явление четко выражено для металлов группы железа и менее сильно для меди, пинка. Оно не наблюдается при осаждении кадмия или свиниа. [17]
Наводороживание стали увеличивается с повышением концентрации адсорбированных атомов водорода, которая зависит от соотношения торможения первой и второй стадий. Все условия, приводящие к торможению второй стадии, способствуют повышению концентрации адсорбированного водорода и, следовательно, увеличению наводороживания. [18]
Примером гетерогенной последующей реакции может служить рекомбинация адсорбированных атомов водорода в молекулу водорода: 2Надс - На. Гомогенные последующие реакции часто встречаются при протекании процессов с участием органических веществ, когда образующиеся органические радикалы рекомбинируют или вступают в другие реакции друг с другом или с компонентами раствори. [19]
Примером гетерогенной последующей реакции может служить рекомбинация адсорбированных атомов водорода в молекулу водорода: 2Надс - На. Гомогенные последующие реакции часто встречаются при протекании процессов с участием органических веществ, когда образующиеся органические радикалы рекомбинируют или вступают в другие реакции друг с другом или с компонентами раствори. [20]
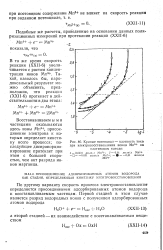 |
Кривые потенциал - плотность тока. [21] |
По другому варианту скорость процесса электровосстановления определяется присоединением адсорбированных атомов водорода к восстанавливаемым частицам. [22]
На кривых потенциал - время отмечаются: ионизация адсорбированных атомов водорода, окисление адсорбированного водорода ( присутствует в виде гидрида) и растворение серебра с образованием пленки труднорастворимой соли. [24]
Энергия связи ( ккал - моль 1) адсорбированных атомов водорода с элементами. [25]
На кривых потенциал - время отмечаются: ионизация адсорбированных атомов водорода, окисление адсорбированного водорода ( присутствует в виде гидрида) и растворение серебра с образованием пленки труднорастворимой соли. [27]
Доказательство неоднородности поверхности представляют данные по изотопному обмену адсорбированных атомов водорода: скорость обмена на различных адсорбционных центрах существенно различается. В пользу неоднородности поверхности платинового электрода говорит тот факт, что логарифмическая изотерма адсорбции получается не только для атомов водорода, но и при адсорбции других веществ: как заряженных ионов, так и нейтральных молекул. Таким образом, при объяснении закономерностей адсорбции на платине необходимо в первую очередь учитывать энергетическую неоднородность ее поверхности, хотя при адсорбции ионов в значительной степени проявляются и силы отталкивания. [28]
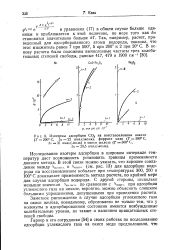 |
Изотермы адсорбции СОа на восстановленном никеле. [29] |
Так, например, расчет, проведенный для адсорбированного атома водорода, показал, что этот множитель равен 7 при 500, 5 при 200 и 2 при 20 С. [30]
Страницы: 1 2 3 4