Внутренний атом
Cтраница 2
Оценим среднее расстояние г между атомами в кластере, содержащем 1 внутренний атом и 8 поверхностных, представляя его в виде кубической решетки с одним дополнительным атомом в центре. В таком кластере имеется 12 связей между поверхностными атомами и 8 - между внутренним и поверхностными атомами. [16]
Атомы, находящиеся на поверхности кристалла, остаются неуравновешенными со стороны внутренних атомов его кристаллической решетки. Силы атомной связи стремятся втянуть атомы, находящиеся на поверхности, внутрь, это и проявляется в поверхностном натяжении, величина которого определяется коэффициентом, равным избыточной поверхностной энергии, отнесенной к единице поверхности центра кристаллизации. [17]
Для разрыва одной из двух ковалентных связей между поверхностным атомом и внутренними атомами требуется большая энергия, которая уменьшается при захвате в зону проводимости одного из электронов, образующих эту связь. [18]
С другой стороны, в ряде случаев правильный выбор главного контура должен учитывать внутренние атомы и включать их в главный контур, если это можно сделать, не уменьшая числа атомов старшего класса. [19]
Расчеты дают следующее распределение зарядов: на атомах азота - О 57, внутренние атомы водорода О 26, внешние О. [20]
Как показано на рис. 87, возможны две формы, где с каждым внутренним атомом соприкасаются или четыре, или шесть симметрично расположенных атомов. [21]
Из этих двух направлений предпочтительно второе, так как в нем имеется непрерывная цепь внутренних атомов. [22]
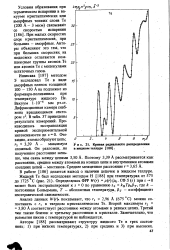 |
Кривая радиального распределения в жидком теллуре. [23] |
Поэтому 3 39 А рассматривается как расстояние, среднее между атомами на концах цепи и внутренними атомами соседних цепей - мостиков. [24]
В отличие от этого характер связей в поверх-костных слоях нередко весьма существенно отличается от свойств связей внутренних атомов. Интересно, что оба основных типа гибридизации, известные для атомов углерода в органических соединениях ( sp3 и sp2), встречаются и в ковалентных кристаллах. Речь идет об алмазе и графите. Графит можно рассматривать как систему двумерных бесконечных бензоидных углеводородов. Отдельные слои удалены друг от друга на расстояние 0 335 нм, поэтому между ними могут действовать только вандер-ваальсовы силы. Электроны р2 - орбиталей занимают в графите МО, которые простираются на весь бесконечный слой; такое описание полностью объясняет хорошую электропроводность графита. Типичным для любой классификации кристаллов является то, что кроме четко определенных их типов существует множество переходных. Это относится и к ковалентным кристаллам, от которых возможен плавный переход к ионным кристаллам. [25]
В отличие от этого характер связей в поверх ностных слоях нередко весьма существенно отличается от свойств связей внутренних атомов. Интересно, что оба основных типа гибридизации, известные для атомов углерода в органических соединениях ( sp3 и sp2), встречаются и в ковалентных кристаллах. Речь идет об алмазе и графите. Графит можно рассматривать как систему двумерных бесконечных бензоидных углеводородов. Отдельные слои удалены друг от друга на расстояние 0 335 нм, поэтому между ними могут действовать только вандер-ваальсовы силы. Электроны р2 - орбиталей занимают в графите МО, которые простираются на весь бесконечный слой; такое описание полностью объясняет хорошую электропроводность графита. Типичным для любой классификации кристаллов является то, что кроме четко определенных их типов существует множество переходных. Это относится и к ковалентным кристаллам, от которых возможен плавный переход к ионным кристаллам. [26]
Голыиая величина анергии тетраиодкислоты по сравнению с дииодкислптпй приписывается поддерживающему влиянию внешнего атома иода в первом соединении на внутренние атомы иода. [27]
Если последний периферический атом соединен с внутренним, то счет продолжается до конца или до разрыва непрерывной цепи внутренних атомов. [28]
 |
Молекулярно-орбитальная диаграмма взаимодействия бутадиена и. [29] |
Далее, индуктивнодействующие заместители у концевых атомов углерода диена должны оказывать меньший эффект, чем аналогичные заместители у внутренних атомов углерода. Этот результат не идентичен полученному ранее [71], где влияние заместителей было рассмотрено только по их воздействию на энергии. [30]
Страницы: 1 2 3 4