Кристалл - платина
Cтраница 4
Как уже отмечалось ранее, ммопьНг для адсорбционного катализа-тора 1 07 % Pt / алюмосиликат 0 гз было выполнено электронно-микроскопическое исследование и найдено, что средний 02 размер кристаллов платины равняется 28 А. [46]
 |
ТПВ оксида платины в катализаторе Pt-ALO., 1188 ]. [47] |
Показано [196], что повышение температуры от 300 до 500 С при обработке водородом катализатора Pt / Al2O3 ( предварительно восстановлен 500 СС, затем окислен О2 450 С), приводит к значительному снижению хемосорбционной емкости платины по водороду, измеряемой отношением Н: Pt. Размер кристаллов платины при этом не увеличивается, что было установлено с помощью электронной микроскопии. Явление это, однако, обратимо, и первоначальное значение Н: Pt можно получить, обработав катализатор кислородом при 450 С и проведя восстановление водородом при 30Q С. [48]
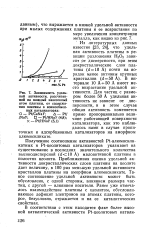
В некоторых случаях при степенях заполнения а, меньших 0 01, активность термически дезактивированных образцов вновь практически достигает исходной величины при дальнейшем повышении температуры. Расчет величины кристаллов платины по адсорбционным данным [3] показывает, что в области активации размер кристаллов уменьшается и они диспергируют. [49]
Оказалось, что средний размер кристаллов в Pt-цеолитных катализаторах увеличивается с ростом концентрации платины для всех серий катализаторов вне зависимости от катионной формы цеолита и способа введения платины. На внешней поверхности гранул были обнаружены кристаллы платины со средним размером от 20 до 80 А. Образование кристаллов такого размера предполагает достаточно высокую подвижность атомов платины в процессе восстановления. [50]
Однако вопреки установившемуся мнению именно эти данные мало показательны при обсуждении вопроса о роли в катализе структурной и энергетической неоднородности кристаллов. В работе О. М. Полторака 50 ], показано, что кристаллы платины размером выше 50 - 40 А после прокаливания при 500 приобретают такие же свойства, как и макрокристаллы платины. Поэтому в работе [47] сопоставляются пять однотипных платиновых поверхностей, удельные свойства которых, естественно, и оказались примерно одинаковыми. По данным О. М. Полторака и В. С. Воронина [51], для процессов с участием водорода различия в удельных активностях различных платиновых поверхностей действительно невелики, йо в окислительных процессах удельные активности отличаются на один-два порядка. [51]
В работе [297] также показано, что хлорирование алюмоплатиновых катализаторов четыреххлористым углеродом в окислительной или инертной среде сопровождается образованием таких интермедиатов, как фосген и летучие хлориды платины. Обработка АПК четыреххлористым углеродом в токе водорода ведет к незначительному увеличению размеров кристаллов платины, а в случае использования газообразного НС1 дисперсность платины не изменяется. [52]
Известно, что для процессов гидрирования активность проявляет не вся поверхность металла; однако до сих пор не ясно с чем это связано - со структурной неоднородностью поверхности или с наличием микропримесей. Митоэдрический метод позволяет установить, отличаются ли свойства активных центров, расположенных на гранях и ребрах кристаллов платины. [53]
 |
Гидрокрекинг луизианской сырой нефти на цеолитном катализаторе при 105 кгс / см2 ( содержание общего азота 140 млн .| Гидрокрекинг остатка атмосферной перегонки. [54] |
Наибольший его выход достигал при поверхности платины 0 7 м2 / г катализатора, что соответствовало содержанию платины около 3 вес. Подсчитано, что среднее расстояние между кислотными центрами платинового катализатора составляет 10 А, а между кристаллами платины - 1500 А ( для алюмосиликата, содержащего 1 вес. Это означает, что кристаллы находятся в окружении кислотных центров, в результате чего, по мнению авторов, и образуются гидрокрекирую-щие активные участки, не закоксовывающиеся в процессе гидрокрекинга. [55]
Снижение дегидрирующей способности объясняется изменением состояния платины в катализаторе, хотя количеств. Некоторые авторы [39] отмечают, что снижение дегидрирующей способности катализаторов в значительной степени связано со спеканием и укрупнением кристаллов платины от 50 - 70 до 200 А и более и уменьшением числа активных центров. [56]
Полученное соотношение активностей Pt-алюмосили-катных и Pt-цеолитовых катализаторов указывает на существование в последних значительного количества высокодисперсной ( d10 А) малоактивной платины в полостях цеолита. Приближенная оценка удельной активности докристаллических слоев платины на цеолите дает величину, в 100 раз меньшую удельной активности кристаллов платины на аморфном алюмосиликате. Такое соотношение удельной активности может быть обусловлено, с одной стороны, влиянием размера частиц, с другой - влиянием носителя. Ранее уже отмечалось взаимодействие платины с цеолитом, обусловливающее дефицит электронов на атомах платины, которое, безусловно, отражается и на ее каталитических свойствах. [58]
Показано, что для процессов гидродегидрогенизации, изотопного обмена водорода, изомеризации углеводородов на платине не играют большой роли ни способ упаковки атомов на поверхности, ни коллективные свойства металлической решетки платины, а важен только контакт атомов платины и реагентов. В ряде случаев оказалось, что заметную рольи грают коллективные свойства металлической решетки и что атомы на ребрах кристаллов платины менее активны, чем атомы, расположенные на гранях. [59]
Страницы: 1 2 3 4