Многовалентный атом
Cтраница 2
Угол связи образуется в многовалентных атомах. Он представляет собой угол между направлениями связей в этих атомах. [16]
Обозначения групп включают атом углерода или другой многовалентный атом и рядом с ним в круглых скобках указывают атомы, с которыми связан этот многовалентный атом. Индексы указывают на б - бензольный, д - винильный, т - ацетиленовый углеродные атомы. Дополнительные вклады - поправки при расчетах - вносят для учета циклов, цис-транс-различий, гош-конфигурации и некоторых других негрупповых взаимодействий, которые осложняют расчеты по аддитивной групповой схеме. Для лучшего согласования с экспериментом было предложено учитывать парноаддитивные взаимодействия функциональных групп, принадлежащих к многовалентным атомам различной отдаленности, т.е. частично учитывать дальнее взаимодействие в молекулах. Успешное использование для расчетов энтальпий образования и испарения ROOH вклада группы О ( О) ( Н) обеспечивается за счет того, что в его величине фактически учтен усредненный вклад мономолекулярных взаимодействий этой группы. [17]
Для радикалов, содержащих более двух многовалентных атомов, принципиально возможна мономолекулярная изомеризация. Она может протекать по механизму отрыва атома, вытеснения, циклизации и распада-механизм этих реакций был подробно рассмотрен в гл. Соображения, высказанные там относительно механизма этих реакций, по-видимому, будут справедливы и здесь. [18]
Таким образом, в реакциях 5н2 - типа у многовалентных атомов, которые не образуют часть системы кратных связей, атака радикалом должна быть неизбежно направлена на внутренние или неконцевые атомы. Именно такие реакции и рассматриваются в настоящей книге. [19]
Число возможных адсорбционных связей заметно возрастает при переходе к более сложным многовалентным атомам. Здесь уже необходимо дополнительно учитывать образование связей с участием трех и четырех электронов, образование ионов более высокой валентности, а также образование одно - и двухэлектронных связей с двумя атомами поверхности. Многообразие форм адсорбции еще более возрастает для двух и многоатомных молекул благодаря диссоциации, возможности различной ориентации молекул. [20]
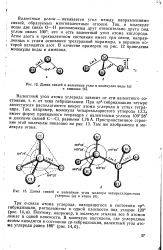
Валентным углом называется угол между направлениями связей, образуемых многовалентным атомом. Так, в молекуле воды две связи О - Н расположены друг относительно друга под углом около 100; это и есть валентный угол атома кислорода. Атом ааота в трехвалентном состоянии имеет три связи. В качестве примеров на рис. 14 приведены длины связей и валентные углы в молекулах воды и аммиака. [21]
Валентным углом называется угол между направлениями связей, образуемых многовалентным атомом. Так, в молекуле воды две связи О - Н расположены друг относительно друга под углом около 100; это и есть валентный угол атома кислорода. Атом азота в трехвалентном состоянии имеет три связи, направленные к углам основания трехгранной пирамиды, в вершине которой находится азот. В качестве примеров на рис. 15 приведены длины связей и валентные углы в молекулах воды и аммиака. Валентный угол атома углерода зависит от типа гибридизации. [22]
До сих пор мы рассматривали молекулы, в которых один многовалентный атом связан с несколькими другими одинаковыми атомами и обсуждали их геометрическую форму. Так, например, три-хлорид бора имеет плоскую тригональную форму, и угол С1 - В - С1 равен 120, а метан - тетраэдрическую форму, и в нем все углы Н - С - Н одинаковы. [23]
Замечательно, что существует аналогия и между проявлениями высшей валентности многовалентных атомов и высшей мультиплет-ности: и та и другая проявляются с большим трудом и высоковалентные атомы чаще дают мультиплеты, не соответствующие их высшей валентности. [24]
 |
Длина связей и валентные углы в молекулах воды ( а и аммиака ( б.| Длина связей и валентные углы молекул четыреххлористого углерода ( а и этана ( б. [25] |
Валентным углом - называется угол между направлениями связей, образуемых многовалентным атомом. Так, в молекуле воды две связи О - Н расположены друг относительно друга под углом около 100; это и есть валентный угол атома кислорода. Атом азота в трехвалентном состоянии имеет три связи, направленных к углам основания трехгранной пирамиды, в вершине которой находится азот. В качестве примеров на рис. 12 приведены молекулы воды и аммиака. [26]
 |
Образование двух гибридных sp - орбиталей путем сложения и вычитания угловых составляющих волновых функций. [27] |
Такой результат объясняется в методе ВС с помощью гибридизации атомных орбиталей многовалентного атома. [28]
Хотя реакциям отрыва атомов посвящены многочисленные обзоры, данные по гемолитическому замещению у многовалентных атомов ( правда, несколько разбросанные), как правило, игнорировались. В этой монографии мы попытались собрать и провести корреляцию всей доступной информации о реакциях гомолитического замещения у многовалентных атомов в надежде тем самым стимулировать развитие как фундаментальной, так и прикладной областей химии свободных радикалов. [29]
Совершенно очевидно, что эти процессы относятся к реакциям бимолекулярного гемолитического замещения у насыщенных многовалентных атомов, однако они не включены в настоящую книгу. Причина этого заключается в том, что реакции замещения горячих атомов представляют собой особый класс реакций, не имеющих прямого отношения к процессам замещения термолизованных атомов. [30]
Страницы: 1 2 3 4