Молекулярная диаграмма
Cтраница 3
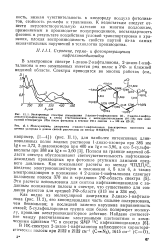
Как видно из молекулярной диаграммы 2-диазо - 1-нафтали-нона ( рис. II. [32]
Тут-кевнчу за расчет молекулярных диаграмм р-хлор - и р р-амиповинилкетонов, проводившийся методом МО ДКАО. [33]
Как видно из молекулярной диаграммы, симметричная Н - связь практически выравнивает заряды на атомах кислорода и водорода. Энергия напряжения для димера равна 22 42 ккал / моль, а для отдельной молекулы в составе димера она составляет 11 21 ккал / моль. Общая длина во-дородносвязанного димера равна 4 71 нм. [34]
Пользуясь приведенными на молекулярных диаграммах электронными плотностями на атомах, легко рассчитать величины частичных зарядов ( 6 или б -) на соответствующих атомах путем вычитания из числа электронов, поставляемых данным атомом в общую it - систему, величины я-электронной плотности на этом атоме. При этом получается более наглядная картина роли данного атома как электроположительного или электроотрицательного центра в молекуле. Соответствующие диаграммы, полученные расчетом по методу Хюккеля, приведены на рис. 3.5; полученные методом самосогласованного поля - на рис. 3.6. Легко видеть, что качественные предсказания, сделанные на основании построения мезомерных структур, подтверждаются и при расчетах методом молекулярных орбиталей в приближении Хюккеля. [35]
В главе 1 приводились молекулярные диаграммы, на которых было указано распределение заряда л-электронов в молекуле, вычисленное методом МО. Такие же сведения можно получить, применяя метод резонанса. [36]
 |
Температуры кипения производных первичных, вторичных и третичных бутанов ( С4Н9Х. [37] |
На рис. I приведены молекулярные диаграммы для бензонитрила, цианопиридинов, фталонит-рилов, 2 6-дицианопиридина и пиромеллитонитри а. Расчеты проведены методом МО в приближении ЛКАО самосогласованного поля. [38]
Приведенные на рис. 13.52 молекулярные диаграммы для молекулы аценафтилена показывают, что при возбуждении происходят значительные изменения порядков связей, а следовательно, и длин связей. Общая форма больших молекул при возбуждении сохраняется, однако возбуждение малых молекул иногда сопровождается существенными изменениями геометрии. Например, многие линейные трехатомные молекулы в возбужденном состоянии принимают изогнутую форму. [39]
Получаемые в настоящее время молекулярные диаграммы описывают стационарное состояние молекул, претерпевающее значительные изменения в ходе химической реакции под действием различных факторов, часть из которых подчас не учитывается или их роли не придается должного значения. Априорныйг выбор условий химических процессов и необходимых реагентов возможен при изучении взаимосвязи и взаимозависимости всех протекающих в химической реакции явлений, причем электронной структуре исходных и реагирующих веществ следует отвести особое место. [40]
Приведенные на рис. 13.52 молекулярные диаграммы для молекулы аценафтилена показывают, что при возбуждении происходят значительные изменения порядков связей, а следовательно, и длин связей. Общая форма больших молекул при возбуждении сохраняется, однако возбуждение малых молекул иногда сопровождается существенными изменениями геометрии. Например, многие линейные трехатомные молекулы в возбужденном состоянии принимают изогнутую форму. [41]
 |
Спектр поглощения аитрахинона ( в диоксаве.| Молекулярная диаграмма антрахинона. а - основное состояние. б - возбужденное состояние. [42] |
На рис. 36 приведены молекулярные диаграммы антрахинона в основном ( а) и первом синглетиом возбужденном ( б) состояниях, составленные по данным квантово-химических расчетов по методу МО ССП. Вычисленные значения я-электронных порядков связей свидетельствуют о высокой выравненное связей в основном состоянии в обоих бензольных кольцах: я-составляющие связей колеблются в пределах 0 649 - 0 669, за исключением связей между атомами 4а - 9а и 8а - 10а, я-составляющие которых понижены до 0 599 взаимодействием с соседними карбонильными группами. Это же взаимодействие ( оттягивание электронов) обусловливает возникновение положительных зарядов на а - ( 1, 4, 5, 8) и р-углеродных атомах ( 2, 3, 6, 7) антрахинона, дезактивирующих молекулу в реакциях электрофильного замещения. [43]
 |
Основные, состояния циклобутадиена и бензола. [44] |
На рис. 1.2.18 приведена молекулярная диаграмма бензола. Порядки всех я-связей и длины всех связей С-С одинаковы. [45]
Страницы: 1 2 3 4