Ацетилирование - аминогруппа
Cтраница 3
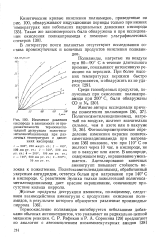 |
Изменение давления кислорода в зависимости от продолжительности термоокислительной деструкции полигекса-метиленсебацинамида при различных температурах и давлениях кислорода. [31] |
Фото колориметрическое определение изменения окраски полигек-саметиленадипинамида при нагревании [36] показало, что при 110 С он желтеет через 10 час. В кислороде, содержащем воду, окрашивание уменьшается. Ацетилирование конечных аминогрупп повышает стойкость волокна к пожелтению. Полигексаметиленадипинамид, обработанный уксусным ангидридом, остается белым при нагревании при 140 С в кислороде. С реактивом Эрлиха только пожелтевший Полигексаметиленадипинамид дает красное окрашивание, означающее присутствие кольца пиррола. [32]
Алкилзамещенные 4-аминонафталимиды обладают флуоресцентной способностью. Так, например, 4-ацетиламино - Ы - бу-тилнафталин-1 8-дикарбоксимид ( 9) - желтый краситель, отличающийся сильной зеленой флуоресценцией. Его получают взаимодействием 4-нитронафталевого ангидрида [ ангидрид 4-нитро-нафталиндикарбоновой - 1 8 ( 4-нитронафталевой) кислоты ] с бу-тиламином в уксусной кислоте с последующим восстановлением нитрогруппы чугунной стружкой и ацетилированием аминогруппы уксусным ангидридом. Краситель применяется для подцветки органических растворителей. [33]
II, мягкие окислители, например иодозобензоат, порфириндин, феррицианид и иод, в определенных условиях являются весьма специфическими. Восстановители действуют только на дисульфидную группу, превращая ее в сульфгидрильную. Однако в тех случаях, когда не созданы максимально благоприятные условия для проявления специфичности, большинство белковых реагентов реагирует более чем с одной функциональной группой. Например, кетен, который часто применяется для ацетилирования аминогрупп, действует также я на фенольные и сульфгидрильные группы. В самом деле, Херриотт и Нортроп [20] в одной из прежних работ нашли, что у кристаллического пепсина первыми ацетшгируются аминогруппы. Несмотря на это, Ли и Кальман [48] обнаружили, что в лактогенном гормоне передней доли гипофиза ацетилируется 75 % фенольных и 35 % аминных групп. Стерн и Уайт [ ЗЗа ] установили то же самое в случае инсулина. Эти данные свидетельствуют о том, что исследование поведения какого-либо белка по отношению к данному специфическому реагенту нельзя иопользавать для суждения о соответствующем поведении других белков. В последующей работе, однако, Херриотту [ 49а ] удалось показать, что инактивация пепсина обусловлена ацетилированием именно фенольных групп тирозина. После обработки кислотой получают ацетилироваяный препарат пепсина, активность которого ( за вычетом всех тех ацетильных групп, которые лабильны при рН 10, и исходного количества фенольных групп тирозина) является 100 % - ной. [34]
Аминофенол используется в производстве красителей и применяется в качестве проявителя в фотографии; он является сильным восстановителем. В промышленности n - аминофенол получают восстановлением - нитрофенола порошкообразным железом и разбавленной соляной кислотой или электролитическим восстановлением нитробензола в растворе серной кислоты. Последняя реакция протекает через стадии образования и перегруппировки фенилгидроксиламина. Типичные N-замещенные производные я-аминофенола могут быть получены несколькими методами, например селективным ацетилированием аминогруппы, которое легко осуществимо в водном растворе. [35]
Страницы: 1 2 3