Ацилирова-ние
Cтраница 3
Хеворта ( 1932 г.), применимый и для получения других конденсированных систем. Согласно этому методу, бензол ацилирова-нием по Фриделю - Крафтсу [ см. раздел 2.2.4.1, получение альдегидов и кетонов, способ ( 15) ] янтарным ангидридом превращают в - у-оксо-карбоновую кислоту, которая восстанавливается далее по Клеменсену [ см. раздел 2.2.4.1, реакции альдегидов и кетонов, реакция ( 15) ] до 4-фенилбутановой кислоты. При его дегидрировании селеном над или палладием на угле получается нафталин. [31]
К реакциями аминирования следует отнести взаимодействие кислот и их производных с аммиаком и аминами, также протекающее по механизму нуклеофильного замещения ( см. с. По традиции они рассматриваются как реакции ацилирова-ния. [32]
Трудность исследования процессов замещения у олефино-вого атома углерода заключается прежде всего в том, что множество реакций, формальный результат которых сводится к замещению у олефинового атома углерода, на самом деле протекают через стадию присоединения с последующим отщеплением. Так протекает, например, сульфирование с помощью комплексно-связанного серного ангидрида, ацилирова-ние в условиях реакции Фриделя - Крафтса, азосочетание с диазосоединениями. Наиболее подходящими для изучения пространственной направленности реакций замещения у олефинового атома углерода являются реакции обмена металлов в металлоорганических соединениях типа X-СН СН-МеХ. [33]
Метил-транс-деканон - 1 дает 2 - ( или 9) ацетил-2 - метил-транс-деканон - 1 и 2-ацетоацетил - 2-метил-транс - деканон-1. При взаимодействии циклогексанона или циклогептанона с гомовератровым ангидридом и BF3 одновременно протекает ацилирова-ние кетона и циклизация образующихся оксикетонов с отщеплением воды. [34]
Имидазол, являющийся электронодонор-ной группой, облегчает первый этап реакции, заключающийся в этерификации серинового остатка самого белка. С помощью специальных приемов исследования очень быстрых реакций удалось проследить за этой первой стадией процесса - ацилирова-нием фермента, независимо от второй - гидролиза промежуточного ацильного соединения белка. [35]
Основная группа с рКа около 4, от которой зависят как ацили-рование, так и дезацилирование, почти наверняка соответствует имидазолу гистиднна-159. Структурные исследования свидетельствуют также в пользу участия этой группы в качестве общего основного катализатора на первой стадии процесса ацилирова-ния. Есть основания также полагать, что и дезацилирование подчиняется механизму общего основного катализа. [36]
В качестве амина применяется ж-нитроанилин, так как нитро-анилины быстро диазотируются ( от этого зависит точность их потенциометрического титрования нитритом), а ж-нитроанилин из трех изомеров ацилируется с наибольшей скоростью. В качестве растворителя применяют нитробензол, так как он обладает большой растворяющей способностью, и, кроме того, скорость ацилирова-ния в среде этого растворителя примерно в 100 раз больше, чем в среде бензола. [37]
Реакции замыкания циклов при каталитическом действии фтористого водорода распадаются на две группы: 1) конденсации ве-шеств, обладающих двумя функциональными группами с многокольчатыми ароматическими соединениями, идущие в пери-положении, и 2) реакции внутримолекулярного ацилирования. На границе между этими группами находится конденсация кротоновой кислоты с многокольчатыми соединениями, которую можно рассматривать или как реакцию алкилирования, сопровождающуюся внутримолекулярной реакцией ацилирования, или как ацилирова-ние, сопровождающееся внутримолекулярным алкилированием. [38]
Относительно малая доступность ( в промышленном масштабе) а-кетокарбоновых кислот, в частности триметилпирови-ноградной, получаемой окислением пинаколина пермангаиатом калия в щелочной среде [330], стимулировала поиск методов синтеза, не связанных с применением свободной а-кетокарбо-новой кислоты. Предложено использовать пивалоилцианид ( LXVII), как более промышлегшодоступное сырье. Ацилирова-нием пивалоилцианида ангидридами алифатических карбоно-вых кислот в присутствии концентрированной серной кислоты получают а-ациламид триметилпировиноградной кислоты ( LXV), который не выделяют из реакционной смеси. [39]
КСН ( КНз) СОО; обладают амфотерными св-вами; плавятся при высоких т-рах ( с разл. Пептиды); ацилирова-ние, напр, ангидридами или хлорангидридами: R COX - Ь NH2CHRCOO - - R CONHCHRCOO - НХ. [40]
Чтобы избежать перегруппировки Хаяши, 2-бензоилбензой-ные кислоты восстанавливают в 2 - 0ензилбензойные кислоты, ко-торые циклизуются легче и без изомеризации. Так, З - метил-2 - ( 2-метилбензил) бензойная кислота ( 137), полуденная восстановлением бензоилбензойной кислоты ( 136) при кипячении с цинковой пылью в 10Р / о-м растворе NaOH. Восстановление оксогруппы в р-ароилпропионо-вых кислотах и последующее внутримолекулярное ацилирова-ние - общий метод синтеза тетралонов-1 и полициклических ке-тонов. [41]
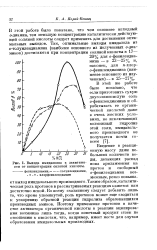 |
Выхода имидазолов в зависимости от концентрации соляной кислоты. [42] |
Таким образом, каталитическая роль протонов в рассматриваемых реакциях кажется нам достаточно ясной. Ко всему сказанному следует добавить лишь то, что кроме упомянутой, роль протонов может еще сводиться к ускорению обратной реакции гидролиза образовавшихся производных аминов. Поэтому применение протонов в качестве активатора органической кислоты в реакции ацилирова-ния возможно лишь тогда, когда конечный продукт стоек по отношению к кислотам, что, например, имеет место для случая образования имидазольных производных. [43]
Аминогруппа легко окисляется азотной кислотой. Поэтому перед нитрованием аминосоединений ее защищают, замещая один атом водорода остатком муравьиной или уксусной кислоты. Введение остатка органической кислоты ( ацила) в аминогруппу называется ацилирова-нием. [44]
Страницы: 1 2 3