Атомные массы
Cтраница 1
Атомные массы, указанные в таблице на внутренней стороне обложки этой книги, представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет конкретно обсуждаться какой-нибудь отдельный изотоп. [1]
Атомные массы некоторых элементов ( Be, Ce, In, Th, U) были несколько изменены Менделеевым по сравнению с тогда существовавшими данными. В таблице оставлены пустые места для неоткрытых элементов. Поразительно то, что детальная проверка атомных масс элементов ( Be, Ce, Di, Те) чешским ученым Браунером подтвердила правильность предположений Менделеева. Еще более поразительным фактом было открытие новых элементов, для которых в таблице периодической системы оставлены свободные места и многие свойства которых предсказаны Менделеевым. [2]
 |
Форма и ориентация электронных орбиталей. [3] |
Атомные массы приведены по углеродной шкале. В квадратных скобках даны массовые числа наиболее устойчивых изотопов. [4]
Атомные массы находятся различными химическими и физико-химическими методами. [5]
 |
Масс-спектр препарата лютеция и европия ( оксалаты. [6] |
Атомные массы ( называемые обычно неточно атомными весами) изотопов имеют значения, значительно более близкие к целым числам, а именно они немного больше или меньше целого числа. Отклонения от целых чисел во всех случаях превышают ошибки эксперимента. [7]
Атомные массы с точностью до 0 1 находят методом определения эквивалентов. [8]
Атомные массы, как и массовые числа, должны иметь целочисленные значения. Содди ( 1877 - 1956) было установлено, что при естественной радиоактивности могут образоваться атомы одного и того же элемента, имеющие одинаковый заряд ядер, но различные атомные массы. [9]
Атомные массы, как и массовые числа должны иметь целочисленные значения. Содди ( 1877 - 1956) было установлено, что при естественной радиоактивности могут образоваться атомы одного и того же элемента, имеющие одинаковый заряд ядер, но различные атомные массы. [10]
Атомные массы также являются функцией этого фундаментального числа. [11]
Атомные массы приведены по Международной таблице. При расчете масс молекул, атомных групп и различных ионов учитывалось, что в Международной таблице атомные массы некоторых элементов ( состоящих только из одного нерадиоактивного изотопа, например Al, As, Au, Be, Bi, Co, Cs, F, I, Mn, Na, Nb, P, Rh, Sc) даны с значительно большим числом знаков после запятой, чем это было в предыдущих таблицах, но, вместе с тем, атомные массы многоизотопных элементов и, среди них, таких распространенных, как углерод, сера, свинец, кислород, выражены числами с значительно меньшим количеством знаков после запятой, чем это делалось раньше. [12]
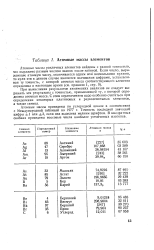 |
Атомные массы элементов. [13] |
Атомные массы приведены по углеродной шкале в соответствии с Международной таблицей на 1977 г. Точность последней значащей цифры 1 или 3, если она выделена мелким шрифтом. В квадратных скобках приведены массовые числа наиболее устойчивых изотопов. [14]
Атомные массы 42 ядер, полученные из масс-спектрографических дублетов. [15]
Страницы: 1 2 3 4