Авидин
Cтраница 2
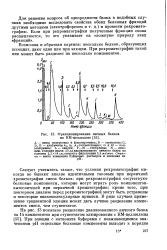 |
Фракционирование яичных белков на КМ-целлюлозе. [16] |
А - смесь овомукоида и флавоцротеина; В - овомукоид; С, D, Е - альбумины Аь Аг А, соответственно; G и Н - кон-альбумины; L - авидин; F - М - глобулины; N - лизо-цим. Условия опыта: 30 жлдиалиаованного яичного белка на колонке 2 2 X14 см; скорость фильтрации 2 5 мл / мин. [17]
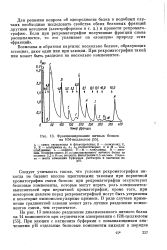 |
Фракционирование яичных белков на КМ-целлюлозе. [18] |
А - смесь овомукоида и флавопротеина; В - овомукоид; С, D, Е - альбумины At, Ai As соответственно; G и Н - кон-альбумины; L - авидин; F - М - глобулины; N - лизо-цим. Условия опыта: 30 мл диализованного яичного белка на колонке 2 2X14 см; скорость фильтрации 2 5 мл / мин. [19]
Как авидин, так и стрептавидин связываются с биотином очень прочно ( константа диссоциации ( Кй 10 - 15); кроме того, каждый из белков имеет четыре независимых биотинсвязывающих сайта, благодаря чему одна молекула авидина или стрептавидина может одновременно присоединять фермент и зонд, меченные биотином. Биотинилирование и связывание со стрептави-дином не приводят к снижению ферментативной активности. В хромогенных системах детекции в том месте, где находится гибридная ДНК, под действием фермента образуется нерастворимый краситель, а в хемилюминесцентных системах - продукт, который испускает свет. [20]
В этом ряду слабая ростовая активность имидазолидонкапроновой кислоты снижается еще более с увеличением или уменьшением числа метиле-новых групп в боковой цепи при испытании на Saccharomyces cerevisiae и Lactobacillus casei; в такой же последовательности уменьшается и способность связываться с авидином. [21]
Колоночную хроматографию применяют для изучения, метаболитов при культивировании микроорганизмов на средах, содержащих биотин, или при биосинтезе биотина и его витамеров. Авидин конденсируют с сефа-розой ( Sepharose 4B), активированной бромцианом. [22]
Более того, для авидина не показана кооперативность. Биологическая функция авидина неясна, хотя он может использоваться в качестве антибактериального агента. Интересно, что некоторые представители Streptomyces производят белок стрептавидин, связывающий биотин и обладающий антибактериальной активностью против граж-отрицательных бактерий. Первичная структура, определенная для авидина, имеет некоторое Сходство со структурой лизоцима, фермента, выделяемого из различных источников, в том числе из яичного белка, и вызывающего лизис бактериальных клеток. Если принять, что в лизо-циме имеется два дополнительных остатка на Л - конце и одна де-леция на С-конце, то в двух белках из куриного яичного белка содержится 15 идентичных положений аминокислотных остатков и примерно столько же консервативных замен. [23]
Для выделения биотина в свободном виде из естественных источников применяется экстракция растворителем после гидролиза соляной кислотой, папаином или после автолиза. В продуктах такой обработки обнаруживается авидин - белок, связанный с биотином. [24]
Некоторые белки, специфически связывающие определенный витамин, обладают антивитаминными свойствами. Таким антивитамином может быть соединение белковой природы - авидин, содержащийся в белке яиц и специфически реагирующий с биотипом, в результате чего он теряет свою биологическую активность. [25]
Цитоплазматическая ДНК - ДНК, локализованная за пределами клеточного ядра. Например, ДНК и ее производные запасаются в яйцеклетках, где она выступает в комплексе со специфическим белком авидином. Найдена Цитоплазматическая ДНК в самореплицирующихся частицах - хлоропластах, в каппа-частицах парамеций-убийц и в митохондриях. В настоящее время эти ДНК особенно интенсивно исследуются в связи с проблемой цитоплазматической последовательности. [26]
Приведенный перечень наиболее часто употребляемых продажных лигандов с групповой специфичностью, которые нам казалось необходимым хотя бы вкратце охарактеризовать, далеко не исчерпывает всего их многообразия. Сюда не вошли, например, аминокислоты, различные сахара и аминосахара, производные холевой кислоты, спермин, протамин, гистон, биотин и авидин, ингибиторы трипсина, апротинин, желатин и др. В этот перечень не были включены и тно-ловые сорбенты для ковалентной хроматографии, в которой используется образование временных связей между лигандом и веществом. Такие сорбенты будут рассмотрены отдельно. [27]
Биотип обладает способностью соединяться с одним из компонентов яичного белка птиц и амфибий, так называемым авидином, образуя с ним нерастворимый в воде и биологически неактивный комплекс - био-тин-авидин. При парентеральном введении ( минуя кишечник) биологическая активнось биотина сохраняется. Авидин, по-видимому, тормозит всасывание биотина в кишечнике. Он получен в кристаллическом виде и является глюкопротеидом. [29]
Страницы: 1 2 3

