Дяобр
Cтраница 2
В этом и в некоторых других справочниках приводятся значения стандартной энтальпии образования ( ДЯобр) и стандартной энтропии ( 5Э) веществ. [16]
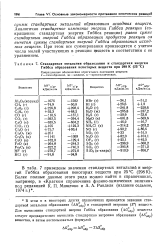 |
Стандартная энтальпия образования и стандартная энергия Гиббса образования некоторых веществ при 298 К ( 25 С. [17] |
В этом и в некоторых других справочниках приводятся значения стандартной энтальпии образования ( ДЯобр) и стандартной энтропии ( 5) веществ. [18]
 |
Энтальпийная диаграмма образования НС1 из простых веществ. [19] |
Значениями энергии связи часто пользуются для вычисления тепловых эффектов реакций, если неизвестны ДЯобр соединений, участвующих в реакции. С другой стороны, значения теплот образования, возгонки, диссоциации и других энергетических эффектов используются для определения прочности межатомных и межмолекулярных связей. [20]
Воспользуемся приведенными в Приложении IV значениями их изобарных теплот образования в стандартных условиях для АЬО3 ДЯобр. [21]
На основании этого закона можно подсчитать значения тепловых эффектов реакций либо по разности теплот образования из элементов ( ДЯобр. [22]
Рассчитаем энергию связи Н - С1 ( АЯ) в молекуле НС1 по известной теплоте образования НС1 ( ДЯобр - 92 кдж / моль) и энергии диссоциации молекул Н2 ( АЯ. [23]
На основании этого - закона можно подсчитать значения тепловых эффектов реакций либо по разности теплот образования из элементов ( ДЯобр. [24]
В энергетическом отношении органические соединения могут быть охарактеризованы энтальпией образования из простых веществ ДЯобр или из атомов ( энтальпией атомизации) ДЯобр - Последняя величина с обратным знаком является энтальпией диссоциации соединения на атомы. [25]
Изменение энтальпии при реакции МпО2 ( к) 2 С ( к) Мп ( к) 2 СО ( г) равно - 293 кДж; ДЯобр со м - 110 5 кДж / моль. [26]
Бесцветная жидкость с отвратительным запахом, / - 81 - - 79 С; г п 23 5 С; рпар 271 0 мм рт. ст. ( 0 С); ( 1Ж 1 140 ( 20 С); ДЯобр - 153 3 кДж / моль. Растворяется в воде с разложением. Полимеризуется при 150 С до циамелида ( НМСО), при 150 С до-циануровой кислоты; жидкая циановая кислота при О С полимеризуется в течение 1 ч, давая смесь юбоих веществ. Разбавленные растворы циановой; кислоты в эфире, бензоле и толуоле устойчивы в течение - неси ильких недель. [27]
 |
Установка для получения С3Ов. [28] |
Бесцветная, очень легко воспламеняющаяся жидкость или бесцветный ядовитый газ с удушливым запахом, t - 111 3 С; tmn 7 C; Рпар 573 5 мм рт. ст. ( 0 С); йж 1 114 ( 0 С); ДЯобр 199 1 кДж / моль. Агрессивен к обычным сортам смазки для кранов, однако не разрушает силиконовую смазку. [29]
На основании данных о теплотах образования фторидов, например SiF4, определенных калориметрически, и о теплоте гидролиза фторидов, протекающего по реакции SiF4 - j - 2H20 - - Si02 4HF, Федер и др. 11 вычислили величину образования газообразного мономера HF, ДЯобр - 64 9 ккал / молъ при 25 С. [30]
Страницы: 1 2 3