Елович
Cтраница 3
Расчету процессов десорбции во взвешенном слое посвящено сравнительно небольшое число работ. Так, Еловичем и Казаковой [15] была исследована кинетика десорбции из силикагеля применительно к частному случаю продувки воздухом сорбента, насыщенного окислами азота. Указанные исследования относятся к периодическому процессу в одиночном взвешенном слое выбранного сорбента. [31]
В Институте химической физдки АН СССР, специально занимающемся вопросами кинетики химических реакций и теории горения, велись, в частности, и работы по макроскопической кинетике. Достаточно назвать хорошо известные работы Еловича, Тодеса, Зельдовича и его школы. [32]
В Институте химической физики АН СССР, специально занимающемся вопросами кинетики химических реакций и теории горения, велись, в частности, и работы по макроскопической кинетике. Достаточно назвать хорошо известные работы Еловича, Тодеса, Зельдовича и его школы. [33]
Анализ для области низкотемпературной необратимой хемосорбции, проведенной Мельником [11] ( в рамках той же самой модели, рис. 5), носит более количественный характер. Этот автор показал, что кинетическое уравнение Еловича 35 ] вытекает из этой модели. [34]
С кинетика хемосорбции кислорода хорошо описывается уравнением Еловича. [35]
С кинетика хемосорбции кислорода хорошо описывается уравнением Еловича. [36]
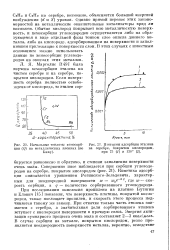 |
Начальные теплоты хемосорбции ( Q на металлических пленках ( по Вику.| Изотермы адсорбции этилена. [37] |
Кинетика адсорбции описывается уравнением Рогииского-Зельдовича, характерным для неоднородной поверхности w w0e - - a1, где w - скорость сорбции, a q - количество сорбированного углеводорода. При исследовании окисления пропилена на платине Бутягин и Елович [15] показали, что поверхность платины, покрытой кислородом, также поглощает пропилен, и скорость этого процесса подчиняется такому же закону. При откачке только часть этилена снимается с серебра, а значительная доля сорбированного этилена вступает с кислородом поверхности в прочную связь. Энергия активации суммарного процесса очень мала и составляет 2 - 3 ккал. [38]
В работах по кинетике реакций окисления углеводородов побочная реакция окисления кислородом решетки обычно не учитывалась. В 1937 г. при выводе кинетических уравнений по окислению СО на Мп02 Елович [251 ] предположил, что катализ происходит на участках свежевосстановленной поверхности МнОа, которая в момент образования обладает повышенной способностью к регенерации. Для этих вариантов механизма реакции кинетические уравнения идентичны. [39]
Мельник указывает, что уравнение Ело-вича согласуется с опытом только при больших q; при малых же q скорость адсорбции значительно выше. Следовательно, модель, изображенная на рис. 5, согласуется с уравнением Еловича примерно во всей области его применимости. [40]
Остин Тейлор и Тон пришли к заключению, что это уравнение описывает процесс, состоящий из двух стадий, а именно поглощения на первичных и вторичных центрах адсорбции. Сравнивая его с кинетическим уравнением, найденным в результате исследования полупроводниковых свойств, можно показать, что выражение Еловича является приближенным по сравнению с более детальным уравнением, полученным упомянутым методом. Возможность измерения изменений полупроводниковых свойств не ограничена случаями простого поглощения или десорбции; этот метод может быть использован также для исследования каталитических реакций. [41]
Второе предположение подтверждается тем, что, как было ранее показано, оно находится в согласии с уравнением Еловича. Однако любая другая лимитирующая стадия хемосорбции кислорода, энергия активации которой зависит от степени заполнения поверхности в соответствии с уравнением Еловича, также согласуется с этими данными. [42]
Из этих примеров можно заключить, что высокая чувствительность описанного метода позволяет детально изучить кинетику исследуемых процессов адсорбции и десорбции. С помощью этого способа можно получать сведения о кинетике в тех случаях, когда общие уравнения, такие, как уравнение Еловича, справедливы в пределах точности обычных методов измерения. [43]
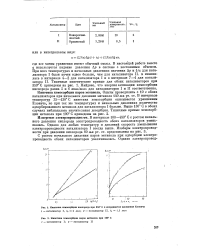 |
Кинетика хемосорбции кислорода при 350 С в координатах уравнения Еловича.| Кинетика хемосорбции па ов метанола при 100 С 1 - катализатор I. 2 - катализатор II. [44] |
Опыты проводились с 10 г обоих катализаторов при начальном давлении метанола 140 мм рт. ст. В интервале температур 35 - 130 С кинетика хемосорбции описывается уравнением Еловича, но при тех же температурах и начальных давлениях количество адсорбированного метанола для катализатора I больше. [45]
Страницы: 1 2 3 4