Елович
Cтраница 4
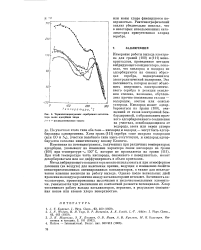 |
Термопотенциограммы серебряного катализатора после адсорбции хлора. [46] |
На участках этого типа оба газа - кислород и водород - могут быть адсорбированы одновременно. Хотя грань ( 111) серебра тоже покрыта водородом ( или СО и N2), участки подобного типа здесь отсутствуют, и кислород адсорбируется согласно кинетическому закону Еловича. [47]
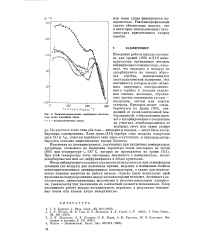 |
Термопотенциограммы серебряного катализатора после адсорбции хлора. [48] |
На участках этого типа оба газа - кислород и водород - могут быть адсорбированы одновременно. Хотя грань ( 111) серебра тоже покрыта водородом ( или СО и N2), участки подобного типа здесь отсутствуют, и кислород адсорбируется согласно кинетическому закону Еловича. [49]
Образовавшийся на поверхности углеводородно-кислородный комплекс ( вероятно, более правильно назвать его перекисным ион-радикалом) в свою очередь окисляется и дает ряд промежуточных кислородсодержащих продуктов, десорбирующихся в объем, где идет их дальнейшее окисление до углекислоты и воды. Все эти стадии могут проходить на поверхности или частично на поверхности, а затем в объеме. На типичном катализаторе глубокого окисления Бутягиным и Еловичем [15] был установлен поверхностно-объемный механизм реакции. [50]
Во всех случаях было обнаружено тормозящее действие каталитической реакции в процессе взаимодействия реагентов с окислом. Такое защитное действие каталитической реакции подобно обнаруженному ранее Рогинским и Еловичем, Ройтером с сотрудниками, подробно проанализировано Розовским. На некоторых окислах расход кислорода в каталитической реакции превышает расход кислорода в каждой из двух других реакций, и в этом случае можно с уверенностью сказать, что окислительно-восстановительная схема катализа не применима. [51]
Исследование окислительных реакций показывает условность приведенного выше деления реакций этого типа по методу их осуществления. Как и во многих других цепных реакциях, разрушение активных форм, ведущих цепь, происходит также в значительной мере на стенке. В то же время, по данным Ковальского и Богоявленской [67], Еловича и Бутягина [15], Полякова [68], в определенных условиях окисление на катализаторах протекает гетерогенно-гомо-генным образом с выходом реакции в объем. [52]
Из рисунка 7 следует, что полный обмен катионов натрия на платинированной платине происходит за несколько минут и не зависит от потенциала, что связано с замедленностью диффузии. Количество прочноадсорби-рованных катионов Na и Cs изменяется линейно с логарифмом времени. Следовательно, для процесса обмена катионов, так же как и в случае анионов, справедливо уравнение Еловича. [54]
В стационарном состоянии сумма чистой скорости образования аммиака из водорода и хемосорбированного азота и скорости десорбции азота должна быть равна сумме скорости хемосорбции азота и скорости образования нитрида в результате разложения аммиака. Он считает, что все эти реакции следуют кинетике активированных процессов и энергии их активации определяются уравнением Еловича. [55]
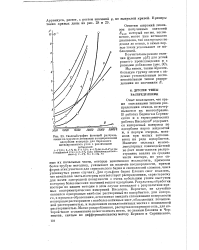 |
Сводпый график функций распределения по ппергиям активации активированной адсорбции водорода для березового актшшровапного угля с различными. [56] |
Опыт показывает, что тремя описанными типами распределения отнюдь не исчерпывается их многообразие. В работах Беринга и Серпин-ского и в термохимических работах Киселева27 содержится интересный материал по адсорбции паров жидкостей и, в первую очередь, метанола при малых заполнениях на ряде адсорбентов. Наличие сильных межмолекулярных взаимодействий не дает возможности распространить анализ на средние части изотерм, но уже самые их начальные части, которые невозможно исследовать, применяя более грубую методику, указывают на наличие неоднородности, причем форма этих участков для сернокислого бария и силикагелей сложнее, чем в упомянутых ранее случаях. Для сульфата бария Елович смог показать, что начальная часть изотермы соответствует распределению, характерному для почти однородной поверхности с очень небольшим узким выступом в сторону более высоких значений теплот адсорбции. Результаты обработки изотерм по нашим методам в этом случае совпадают с результатами прямых калориметрических измерений Киселева. Вероятно, не случайно оказался однородным наиболее растворимый из адсорбентов, для которого, в процессе образования, естественно ожидать сглаживания поверхности повторным растворением с наиболее активных мест, обладающих повышенной растворимостью, и выделением на малоактивных местах с пониженной растворимостью. [57]
Энергию активации адсорбции Еа определяли из кривых 1п ( г) 9 - 1 / Т, причем было найдено, что при постоянном давлении энергия активации возрастает с заполнением по линейному закону ( в первом приближении) от 0 до примерно 35 ккал / моль для NiO и Сг2О3 и от О до величин, значительно превышающих 12 ккал / моль для FejOs. В случае FezOs поглощение и скорость приближения к равновесию были недостаточно большими для точных измерений верхнего предела величин энергии активации. Путем проведения адсорбции порции кислорода, обогащенного О18, с последующей адсорбцией обычного газа было показано, что до достижения насыщения десорбция с этих трех окислов ничтожна. Энгель и Хауффе [26] изучили кинетику адсорбции О2 на NiO при температурах от комнатной до 700 на образце с довольно малой поверхностью ( около 1 м2 [ г) и обнаружили соответствие уравнению Еловича, хотя ниже 300 кривые зависимости q от lg ( t ta) претерпевали разрыв, что авторы связывают с наличием двух процессов - хемосорбции и внедрения в решетку, первый из которых при 300 и выше является медленным. [58]
Праут [43] применяет уравнение Праута - Томпкинса. В результате этого не создается целостной картины разложения, хотя метод Ерофеева следует считать наиболее общим; он, в частности, учитывает возможность старения реагирующего вещества. Они ввели полезный метод кинетического анализа и с помощью него показали, что в зависимости от условий хранения перманганат калия может разлагаться как по кубическому, так и по экспоненциальному уравнению. В результате представляется возможным согласовать между собой экспериментальные данные, кажущиеся противоречивыми, как это ранее было сделано при обработке казалось бы противоречивых результатов, полученных при исследовании гремучей ртути и оксалата серебра. Елович, Рогинский и Шмук [45] рассматривали относительную устойчивость перманганатов, введя для этого понятие о температуре разложения, за которую они приняли ту температуру, при которой максимальная скорость достигается за 120 лшк, считая при этом, что разложение описывается обычной сигмоид -; ной кривой. [59]
Страницы: 1 2 3 4