Баннет
Cтраница 1
Баннет [48] перечисляет 17 свойств, важных с точки зрения влияния на нуклеофильность, тогда как Стрейтвизер [49] указывает на следующие, имеющие особое значение: ( 1) энергия сольватации основания Льюиса; ( 2) сила его связи с 2р - орбиталыр углерода; ( 3) его эффективный объем; ( 4) электроотрицателыгость атакующего атома и ( 5) поляризуемость атакующего атома. [1]
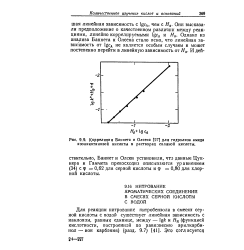 |
Корреляция Баннета и Олсена для гидролиза амида изоникотиновой кислоты в растворах соляной кислоты. [2] |
Баннет и Олсен - установили, что данные Цук-кера и Гаммета превосходнз описызаюгся уравнением ( 34) с ф 0 62 для серной кислоты и ф 0 80 для хлорной кислоты. [3]
Баннет и Рендолл56 показали, что реакция между 1-фтор - 2 4-динитробензолом и N-метиланилином катализируется основаниями, тогда как реакции соответствующих хлорида и бромида такому катализу не подвержены. [4]
Баннет и Мерке573 68, используя оптически-активную смолу, полученную на основе оптически-активных - ( оксифенил) - масля-ной кислоты или N - n - толуолсульфотирозина, пытались разделить на ней а-пипеколин, а-метилбензиламин, 4-диметиламино - 2 2-дифенилвалеронитрил, етог-бутиламин, к-п-толилэтиламин и 2-аминогептан, но во всех случаях не наблюдали разделения. [5]
Баннет обработал по уравнению ( 111 - 37) зависимости & Эф от Н для 96 реакций и нашел, что в координатах ( 1 § / гЭф - - Н) - Ig H о они приблизительно линейны. При этом значения со, найденные по наклону полученных прямых, непосредственно характеризуют механизм реакции. [6]
Баннет и Раухат [199] показали, что а-наф-гилцианид не способен гидролизоваться до а-нафтойной кислоты в условиях, при которых р-нитронафталин претерпевает перегруппировку Рихтера, давая а-нафтойную кислоту. Этот факт свидетельствует о том, что нитрил не может быть интер-медиатом в этом случае, и ставит под сомнение такую возможность в других случаях, поскольку маловероятно, чтобы действовали различные механизмы. Ранее предполагалось, что все атомы азота в ходе реакции превращаются в аммиак, образование которого не противоречит наличию нитрильного интермедиата, поскольку аммиак является продуктом гидролиза нитрилов. В то же время было показано, что N02 - не является главным продуктом реакции. Обнаружение в продуктах реакции азота указывало на то, что в ходе реакции должна образовываться связь азот - азот. [7]
Баннет сформулировал анион-радикальный механизм нуклеофильного ароматического замещения и предложил принципиально новый способ активации ароматических соединений, не содержащих активирующих электроноакцепторных заместителей, в нуклеофильном замещении галогена. Реакция инициируется переносом одного электрона от восстановителя к арилгалогениду. [8]
Баннет и Цалер [263] рассмотрели эту реакцию и предложили ее механизм, первая стадия которого состоит в присоединении цианид-иона в р-положение двойной связи углерод - углерод, сопряженной с нитрогруппой; в алифатическом ряду аналогично происходит р-присоединение цианид-иона к сс р-ненасыщенным эфирам. Авторы предполагают, что процесс замещения завершается после захвата протона из спиртовой среды отщеплением азотистой кислоты и гидролизом циангрушш. Первая стадия этого механизма - присоединение цианид-иона - в настоящее время принята всеми, однако механизм стадии отщепления азотсодержащей группы, вероятно, иной. На основании этих фактов можно предложить приведенный ниже механизм реакции, идею которого Розенблюм приписывает Вудварду. [9]
Баннет и Тарбелл [113] впервые показали, что кадмийорганические соединения при действии хлорангидридов галоидированных алифатических карбоновых кислот реагируют, в первую очередь, с галоидом карбонильной группы, не затрагивая атома галоида в углеводородной цепи. [10]
Баннет и Рэндолл [80] вполне однозначно показали, что ацетат-ион катализирует реакцию 2 4-динитрофторбензола и N-метиланилина в этаноле, а также в смеси 60 % диоксана и 40 % воды. Кроме того, они получили данные, которые существенно подкрепляют предположение, что гидроксил-ион также оказывает каталитическое действие. В спирте скорость реакции, катализируемой ацетат-ионом, линейно зависит от его концентрации, В некоторых опытах авторы добавляли в исходную смесь уксусную кислоту, которая сама по себе не катализирует реакцию в количествах, эквивалентных содержанию ацетата калия. Оказалось, что добавка уксусной кислоты не приводит к замедлению каталитической реакции. Из этого следует, что увеличение скорости замещения обусловлено присутствием ацетата калия, а не гидроксил-ионов. Каталитическое действие гидроксил-ионов изучалось в среде 60 % диоксана и 40 % воды. И в данном случае высокая реакционная способность гидроксил-иона по отношению к субстрату сильно затрудняет исследование этого эффекта. Характерно, что выход Ы - метил-2 4-динитро-дифениламина во всех опытах с добавкой гидроксил-иона не достигал даже 2 %, считая на исходный 2 4-динитрофторбензол. Тем не менее в присутствии гидроксил-иона образование замещенного дифениламина ускоряется настолько заметно ( почти в 8 раз при наиболее высокой из применявшихся концентраций ОН), что существование каталитического эффекта можно считать доказанным. Далее авторы приходят к заключению, что скорость реакции, катализируемой ОН -, зависит не линейно от его концентрации. [11]
Грутфиорд и Баннет [40] недавно сообщили о циклизации N-ацилированных о - и и-галогенанилинов под действием амида калия в жидком аммиаке. Здесь к замыканию цикла способны не только анионоидная сера и углерод, но и кислород. [12]
В 1970 г. Баннет и Ким предложили новый механизм нуклеофильного ароматического замещения неактивированных ароматических соединений; в последующие годы ряд исследований в этой области продемонстрировал распространенность этого механизма среди различных субстратов и нуклеофилов. [13]
В 1961 г. Баннет [31] решил обе эти проблемы. Он показал, что шкалы кислотности, применяемые к равновесию в водных растворах кислот, зависят в большой мере от изменения активности растворителя - воды и, следовательно, от количества связанной воды, включая сольватационную, которое высвобождается или связывается с растворенным веществом в результате переноса протона. Высвобождение связанной воды более благоприятствует течению реакций при высокой кислотности, когда раствор менее богат свободными молекулами растворителя - воды. Шкала h0 была построена для выражения равновесия переноса протона от сильно гидрофильных молекул воды к умеренно гидрофильным органическим азотистым основаниям. Шкала h0 прекрасно отражает равновесный перенос протона к умеренно гидрофильным органическим азотистым и органическим кислородным основаниям. Однако, когда высвобождается слишком большое количество связанной воды, что бывает при переносе протона от воды к гидрофобным углеродным основаниям, тогда функция h0 становится неприменимой. Баннет пришел к заключению, с которым следует согласиться, что функция Гаммета / г0 иногда все же дает приближенное описание псевдоравновесного частичного переноса протона и связанного с этим переносом частичного высвобождения воды, протекающих при образовании переходного состояния переноса протона к углероду. [14]
Имеются и другие толкования этих отношений скоростей. Баннет [34], например, связывает log ( ks / ku) с поляризуемостью уходящей группы и рассматривает его на основании сил Лондона. [15]
Страницы: 1 2