Бартел
Cтраница 2
Предложены и другие уравнения электропроводности; их обзор сделан Бартелом [2], однако они не нашли широкого применения для обработки экспериментальных результатов. В настоящее время теории межионного взаимодействия и электропроводности интенсивно разрабатываются несколькими группами исследователей, поэтому в ближайшем будущем можно ожидать дальнейшего усовершенствования этих теорий. [16]
 |
Поверхности силикагеля и угля из сахара. [17] |
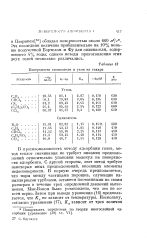
Эта последняя величина приблизительно на 10 % меньше полученной Бартелом и Фу для силикагеля, содержащего 4 % воды; однако методы приготовления этих двух гелей несколько различались. [18]
Ни аа, ни asl не поддаются непосредственному измерению, но Бартел п Остергоф [54] разработали метод для измерения разности этих двух величин. Таким образом, для определения поверхности адсорбента необходимо знать о и da ] dT для применяемой жидкости и определить экспериментально qw и. Измерение теплоты смачивания проводится калориметрически, в то время как определение А я включает измерение трех давлений вытеснения. [19]
В связи с этими выводами следует заметить, что годом раньше Бартел [67] пришел к выводу о влиянии на длины связей внутримолекулярных вандерваальсовых сил, приводящем, например, к удлинению связи С - С в алмазе на 0 01 А по сравнению со связями С - С в нормальных парафинах. Существование невалентных сил отталкивания заставляет с осторожностью относиться к вычислениям гибридизации из валентных углов, так как эти силы не только могут привести к искажению валентных углов ( до 3), но и к изгибанию связей ( bending of the bonds), которое, впрочем, в нормальных углеводородах почти не сказывается на длинах связей С - С. [20]
Ни as, ни asl не поддаются непосредственному измерению, но Бартел и Остергоф [54] разработали метод для измерения разности этих двух величин. Таким образом, для определения поверхности адсорбента необходимо знать а и dajdT для применяемой жидкости и определить экспериментально qw и Ка. Измерение теплоты смачивания проводится калориметрически, в то время как определение Ка включает измерение трех давлений вытеснения. [21]
 |
Различия в дипольных моментах изотопных многоатомных молекул. [22] |
Это связано с тем, что при расчете автор по невнимательности не учел множитель 1 / 27 Ряд расчетов, проведенных недавно Бартелом [ 24а ], подвергают сомнению допущение, принятое в приближенном расчете [19], о независимом характере деформационных и валентных колебаний связей в молекуле аммиака. По данным Бартела, различия в дипольных моментах изотопных молекул могут появиться только при наличии достаточно большого по величине члена, включающего квадрат углового смещения, и таким образом зависят от изотопных различий в величине среднеквадратичной амплитуды. [23]
Одним из эффективных методов решения уравнения ( 4 - 24), получившего в литературе название матричного уравнения Ляпунова [14], является алгоритм Бартела - Стюарта [34 ], основанный на предварительном преобразовании матрица Ар к верхней вещественной форме Щура. [24]
Некоторые вещества, такие как амины, очень сильно адсорбируются на силикагеле до точки, отвечающей образованию монослоя. Бартел и Добай [75] нашли, что адсорбция диэтиламина, моно - и дибутиламинов очень быстро возрастает в области Р / Ро от 0 до 0 01, в течение времени, когда образуется адсорбированный монослой. [25]
Это связано с тем, что при расчете автор по невнимательности не учел множитель 1 / 27 Ряд расчетов, проведенных недавно Бартелом [ 24а ], подвергают сомнению допущение, принятое в приближенном расчете [19], о независимом характере деформационных и валентных колебаний связей в молекуле аммиака. По данным Бартела, различия в дипольных моментах изотопных молекул могут появиться только при наличии достаточно большого по величине члена, включающего квадрат углового смещения, и таким образом зависят от изотопных различий в величине среднеквадратичной амплитуды. [26]
Модель Рандла не требует привлечения d - орбиталей центрального атома, а использует для образования аксиальных связей его Зр-орбитали, что определяет большую длину и полярность аксиальных связей по сравнению с экваториальными. Схема Рандла находится в хорошем согласии с данными Бартела и Хансен; 1 4, однако она не ведет к прямому предсказанию величин параметров связей, что обусловлено произвольным допущением о полном использовании Ss-орбиталей в экваториальных связях. [27]
Поэтому необходимо, чтобы пространственное сжатие в переходном состоянии увеличилось, что, по-видимому, вполне правдоподобно. Тот же результат можно было получить при использовании потенциальной функции Бартела, положительная вторая производная которой преобладает в своем влиянии над отрицательной первой производной. В данном случае трудно определить, какой из этих подходов является более правильным. Первый из них ближе к методу, использованному при рассмотрении изотопных эффектов в дипольных моментах, и основан на принятой нами простой модели. Однако он будет непригодным, если расчеты для аммиака, выполненные Бартелом [ 24а ], окажутся верными ( см. второе примечание на стр. [28]
Наибольшая неточность при расчете, возможно, вызвана выбором приблизительного ионного радиуса R. Изучая ряд модельных систем ( в основном спиртовые растворы алкиламмониевых солей), Бартел экспериментально показал, что последнее приближение лучше описывает имеющиеся данные. [29]
По его мнению, снижение устойчивости при переходе к недейтерированному соединению в случае такого пространственно напряженного комплекса, как ( СНз) зВ: N ( CH3) 3, связано с увеличением отталкиваний несвязанных атомов в недейтерированном соединении. Следует, однако, отметить, что величина изотопного эффекта, следующая из расчетов Бартела, решающим образом определяется выбранным значением длины В - N-связи. Поскольку точная структура комплекса не известна, а также принимая во внимание недостатки, свойственные расчетам по методу Бартела ( разд. IIIB, 1), можно заключить, что относительная роль эффектов гиперконъюгации и несвязанных взаимодействий для данного равновесия остается неизвестной. [30]
Страницы: 1 2 3