Потенциальный барьер - реакция
Cтраница 1
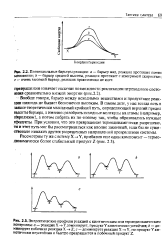
Потенциальные барьеры реакции: а - барьер мал, реакция протекает почти мгновенно; Ь - барьер средней высоты, реакция протекает с измеримой скоростью; с - очень высокий барьер, реакция практически не идет. [2]
Вершина кривой представляет собой потенциальный барьер реакции. На самом деле путь фигуративной точки не лежит в одной вертикальной плоскости, поэтому проходимый проекцией фигуративной точки путь ( путь реакции) не следует рассматривать как реальную длину. [3]
Отсюда следует, что с графитом взаимодействуют такие частицы, для которых потенциальный барьер реакции мал. Реагирующие частицы образуются в непосредственной близости от поверхности графита. [4]
Скорость фазового превращения определяется термодинамическим стимулом превращения и вероятностью термодинамически активируемого преодоления потенциальных барьеров реакции. [5]
При любом ином соотношении Q и Q, например Q - 9 и Q - 11, потенциальный барьер реакции увеличивается, одна из рассматриваемых стадий - реакционная - становится лимитирующей и скорость реакции снижается. [6]
 |
Соударение частиц. [7] |
Согласно теории соударений химическое взаимодействие имеет место при каждом соударении реагирующих частиц, обладающих достаточной энергией для преодоления потенциального барьера реакции и должным образом ориентированных относительно друг друга. [8]
Согласно теории соударений химическое воздействие имеет место при каждом соударении реагирующих частиц, обладающих достаточной энергией для преодоления потенциального барьера реакции и должным образом ориентированных относительно друг друга. Отсюда следует, что скорость бимолекулярных реакций пропорциональна числу соударений реагирующих частиц в единице объема за единицу времени. [9]
Все эти области химии, несмотря на их различия, имеют то общее, что они связаны с преодолением потенциального барьера реакций путем подачи энергии в реакционную систему извне. [10]
Согласно теории соударений, химическое взаимодействие имеет место при каждом соударении реагирующих частиц, обладающих достаточной энергией для преодоления потенциального барьера реакции и должным образом ориентированных относительно друг друга. [11]
Как было показано, величина константы скорости химической реакции определяется исходным состоянием реагирующих частиц, конфигурацией активированного комплекса и высотой потенциального барьера реакции. [12]
В работах [57-59] рассмотрены различные кооперативные модели реакций в твердой фазе, из которых, в частности, следует возможность уменьшения общего потенциального барьера реакции с ростам температуры. [13]
Теория активных столкновений ( Аррениус) основана на том, что химическое взаимодействие осуществляется только при столкновении активных частиц, которые обладают достаточной энергией для преодоления потенциального барьера реакции и ориентированы в пространстве друг относительно друга. Чтобы произошла реакция, частицы в момент столкновения должны обладать некоторым минимальным избытком энергии, называемым энергией активации. [14]
Поэтому любая другая молекула, обладающая неспаренным электроном, может образовать связь с возбужденной молекулой, как только их орбиты начнут перекрываться. Таким образом, потенциальный барьер реакции снижается. [15]
Страницы: 1 2 3