Наклон - волна
Cтраница 3
При малых концентрациях этанола восстанавливаются плоскоориентированные адсорбированные молекулы кислот; в области средних концентраций спирта - расположенные перпендикулярно поверхности электрода; при высоких концентрациях спирта восстанавливаются молекулы, условно названные неадсорбированными. На примере волн а-бромкапроновой кислоты подтверждена найденная ранее количественная зависимость между Е1 / г и наклоном волн восстановления адсорбированных веществ. Показано, что максимум первого рода на волнах изученных кислот появляется при почти полном покрытии поверхности электрода адсорбированным продуктом реакции. [31]
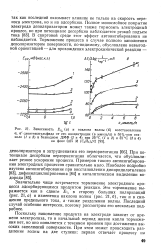
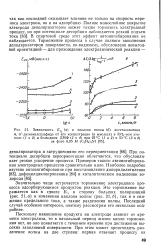
Значительно чаще встречается торможение электродного процесса адсорбирующимся продуктом реакции. Это торможение выражается как в сдвиге Е г в сторону больших поляризаций ( рис. 21, а) и изменении наклона волны ( рис. 21 6), так и в снижении предельного тока, а также разделении волны. Последний случай особенно интересен, поэтому рассмотрим его несколько подробнее. [33]
Значительно чаще встречается торможение электродного процесса адсорбирующимся продуктом реакции. Это торможение выражается как в сдвиге Ei / 2 в сторону больших поляризаций ( рис. 21, а) и изменении наклона волны ( рис. 21 6), так и в снижении предельного тока, а также разделении волны. Последний случай особенно интересен, поэтому рассмотрим его несколько подробнее. [35]
Формально аналогичные кривые зависимости Ei /, от рН наблюдаются в случае тех необратимых полярографических волн, когда в электрохимических процессах, отвечающих этим волнам, прото-низация предшествует замедленному переносу электронов. Однако из такой зависимости в этих случаях уже нельзя определить число протонов, участвующих в суммарном процессе, так Как на величину наклона волны в данном случае влияет кинетика переноса электрона ( и протонов), на которую в свою очередь оказывают влияние эффекты строения двойного слоя и адсорбция. [36]
Формально аналогичные кривые зависимости Ei / 2 от рН наблюдаются в случае тех необратимых полярографических волн, когда в электрохимических процессах, отвечающих этим волнам, прото-низация предшествует замедленному переносу электронов. Однако из такой зависимости в этих случаях уже нельзя определить число протонов, участвующих в суммарном процессе, так Как на величину наклона волны в данном случае влияет кинетика переноса электрона ( и протонов), на которую в свою очередь оказывают влияние эффекты строения двойного слоя и адсорбция. [37]
Из этого уравнения следует, что графическая зависимость g [ i / ( inp - 01 от Е представляет собой прямую, коэффициент обратного наклона которой равен 0 059 / / г. В случае le - процесса обратный наклон при 25 С равен 59 мВ, а в случае 2е - процесса 29 5 мВ [ 1, с. В случае некоторых в целом необратимых процессов, потенциалопределяющая стадия которых обратима, но имеются последующие необратимые химические и электрохимические превращения по наклону волны также можно определить число электронов па, затрачиваемых в актива-ционной ( потенциалопределяющей) стадии. [38]
Различие в форме необратимых волн и величинах а, полученных из значений наклона волн на капельном и неподвижном электродах [ в последнем случае из значения наклона волны по уравнению ( 9) может быть найдена истинная величина а ], обусловлено, как это отметил А. Н. Фрумкин [38], тем, что на растущей поверхности капельного электрода при сохранении ее потенциала постоянным концентрация необратимо разряжающегося деполяризатора у поверхности электрода изменяется в течение периода жизни капли. [39]
Наличие же двух электрохимических реакций проявляется в изломах кривых в полулогарифмических координатах. Хотя в области р понижены как скорость адсорбции, так и скорость протонизации ( обе они сказываются на скорости необратимого Зе-процесса и таким образом влияют на наклон общей волны и ее потенциал полуволны), все же сила предельного тока ограничена скоростью диффузии молекул и волна сохраняет высоту четырехэлектронной квазидиффузионной волны. [40]
В водно-метанольном растворе Ei / t первого вещества равен - 1 80 в ( нас. Отмечено, что в то время как в случае изомеров производного этилена наклоны волн заметно различаются ( волна г ыс-изомера, восстанавливающегося при более отрицательных потенциалах, более крутая), в случае изомеров производного гексена наклоны волн практически одинаковы. Восстановление протекает с участием двух электронов и образованием, по-видимому, соответствующих ацетиленовых производных. Восстановление изомерных 2 3-дихлоракрилонитрилов CH2C1CC1CN, по данным Джуры и Гола [38], протекает при несколько различных потенциалах и приводит, по-видимому, к различным продуктам: транс-изомер восстанавливается по обычному для вициаль-ных дигалоидных соединений пути с образованием тройной связи, а tyuc - изомер отщепляет только один атом хлора, который замещается на водород. [41]
При уяснении всех указанных эффектов следует иметь в виду, что первая стадия электровосстановления нитрогруппы протекает при потенциалах, близких к потенциалу нулевого заряда, вследствие чего существенное значение приобретает как адсорбция молекул деполяризатора, так и адсорбция ионов водорода и обусловленное последним изменение значения рН в приэлектродном слое. С увеличением содержания спирта в растворе происходит некоторое вытеснение молекул деполяризатора из поверхностного слоя, вследствие чего уменьшается как скорость протонизации, так и скорость присоединения электрона к молекуле, о чем свидетельствует отмеченное выше уменьшение наклона волны с увеличением концентрации спирта. В данном случае можно было бы говорить о существенном замедлении протонизации при менее значительном замедлении скорости переноса электрона, и, следовательно, влияние рН на рп-константу в средах с высоким содержанием спирта сказывается больше. [42]
Для этого на график в координатах dEjdi против 1 / t d наносят точку, ордината которой отвечает обратной величине наклона ( не логарифмического графика. Если электродный процесс осложнен адсорбционными явлениями, но полулогарифмическая зависимость волны прямолинейна, то в принципе подобным же образом можно найти R, однако очень трудно найти истинную ( не искаженную падением напряжения в растворе) величину наклона волны. Исходя из этого, для определения R по этому способу следует рекомендовать использовать волну обратимо разряжающегося иона ( для которой известна теоретическая величина наклона RT / nF), снимая эту волну точно в тех же условиях, в которых проводится съемка полярограмм изучаемых веществ. [43]
Скорость взаимодействия дианиона с растворителем невелика и мало сказывается на высоте полярографической волны. Однако некоторые выводы авторов [125] нуждаются в более строгом обосновании. Оценка обратимости процесса по наклону волны или по разности потенциалов анодного и катодного пиков затруднительна, если обратимый перенос первого и второго электрона происходит при различающихся потенциалах. [44]
На примере органических галогенидов установлено также влияние конформации соединения на механизм и потенциалы полярографического восстановления конформеров. При изучении 3 4-ди-бромциклогексанов и 2 3-дибромбицикло [1.2.2] гептанов оказалось [120, 121], что значительные ( до 600 мВ) различия между потенциалами полуволны могут быть объяснены различной взаимной ориентацией связей С - Вг. Направленность связей сказывается и на значениях наклонов волны. Указанные закономерности аналогичны наблюдаемым и при чисто химических реакциях отщепления геминальных атомов галогена. [45]
Страницы: 1 2 3 4