Накопление - продукт - реакция
Cтраница 2
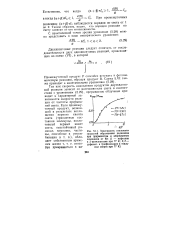
При рассмотрении кинетики накопления продуктов реакции и расхода исходных веществ обращают на себя внимание следующие факты. Количество перекисей, постепенно увеличиваясь, достигает максимального значения ( 10 - 11 мм рт. ст., что для 210 еще не является критической концентрацией взрывного распада) к моменту, отвечающему максимальному падению давления, и затем, уменьшаясь на всем протяжении подъема давления, полностью исчезает к концу реакции. Очень своеобразно расходуются пропан и кислород; к моменту достижения максимума падения давления они расходуются примерно в равных количествах. На ветви подъема давления пропан дальше практически не расходуется, кислород же продолжает участвовать в реакции и к концу ее полностью исчезает. Метан образуется в количествах, значительно больших, чем этилен. [16]
Так как скорость накопления продуктов двухкванто-вой реакции зависит от интенсивности света в соответствии с уравнением (5.29), прерывистое облучение приводит к характерной за-висимости скорости реак-ции от частоты прерываний света. [18]
Радикалы RO2 по мере накопления продуктов реакции реагируют не только с исходным веществом, но и с более реакционно-способными продуктами его превращения - гидроперекисями, спиртами, кетонами, сложными эфирами. [19]
Скорость окисления измеряли по накоплению продукта реакции - гидроперекиси, последнюю определяли иодометрически. [20]
 |
Зависимость выхо. [21] |
Повышение плотности тока способствует накоплению продуктов реакции Сгв - Сг31 - и уплотнению пленки, что приводит к затруднению более легко идущих реакций и способствует увеличению скорости осаждения металлического хрома. [22]
Сопоставление кинетических кривых свечения и накопления продуктов реакции показывает, что на этих кривых нет каких-либо особых точек, совпадающих во времени. В частности, второму максимуму свечения не отвечает ни максимальная скорость накопления, ни максимальная концентрация какого-либо вещества. Следовательно, хемилюминесценция не связана непосредственно с образованием тех продуктов, которые анализировались по ходу процесса. [23]
Радикалы R02 - по мере накопления продуктов реакции реагируют не только с исходным веществом, но и с более реак-ционноспособными продуктами его превращения - гидроперок-сидами, спиртами, кетонами, сложными эфирами. [24]
Радикалы RO2 - по мере накопления продуктов реакции реагируют не только с исходным веществом, но и с более реак-ционноспособными продуктами его превращения - гидроперок-сидами, спиртами, кетонами, сложными эфирами. [25]
В интервале указанных параметров изучена кинетика накопления продуктов реакции ( рис. 2), которая показывает, что процесс окисления практически заканчивается за час. Уже при низкой конверсии ИМА наблюдается образование, кроме ИМ: К, многих молекулярных продуктов: ацетона, изопропанола, изопропилфор-миата, надизомасляной кислоты, перекисных соединений. [26]
В индукционный период происходит медленное образование и накопление продукта реакции - катализатора, а затем наступает резкое увеличение скорости реакции за счет вступления катализатора в действие. [27]
Действительно, при интегрировании системы дифференциальных уравнений накопления продуктов реакции окисления циклогексена в присутствии ацетилацетонатов скандия, лантана и неодима, отвечающей схеме реакций ( 3), адекватное описание всех экспериментально найденных кинетических кривых достигается, начиная с момента времени. Аналогичный результат имеет место при обработке экспериментальных данных в случае катализа процесса ацетилацетонатом железа и никеля. Интегрирование системы дифференциальных уравнений с момента времени t 90 мин ( катализ Fe ( асас) 3) и i 120 мин ( катализ Ni ( асас) г), при соответствующих этим точкам значениям концентраций продуктов, также приводит к адекватному описанию кривых накопления продуктов реакции. Этот факт однозначно указывает на то, что в ходе окисления гомогенный катализатор превращается в неактивную форму, образование которой можно объяснить выпадени - ем катализатора в осадок. [28]
Действительно, при интегрировании системы дифференциальных уравнений накопления продуктов реакции окисления циклогексена в, присутствии ацетилацетонатов скандия, лантана и неодима, отвечающей схеме реакций ( 3), адекватное описание всех экспериментально найденных кинетических кривых достигается, начиная с момента времени t 60 мин. Аналогичный результат имеет место при обработке экспериментальных данных в случае катализа процесса ацетилацетонатом железа и никеля. Интегрирование системы дифференциальных уравнений с момента времени t 90 мин ( катализ Fe ( асас) 3) и I 120 мин ( катализ Ni ( acac), при соответствующих этим точкам значениям концентраций продуктов, также приводит к адекватному описанию кривых накопления продуктов реакции. Этот факт однозначно указывает на то, что в ходе окисления гомогенный катализатор превращается в неактивную форму, образование которой можно объяснить выпадением катализатора в осадок. [29]
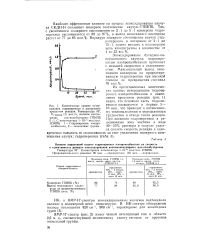 |
Кинетические кривые исчерпывания гидроперекиси и накопления продуктов реакции. Температура 95, С т. [30] |
Страницы: 1 2 3 4