Накопление - продукт - реакция
Cтраница 3
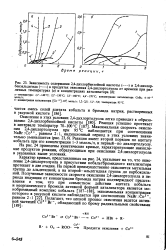
Из представленных кинетических кривых исчерпывания гидроперекиси изопропилбензола и накопления продуктов реакции ( рис. 1) видно, что основная часть гидроперекиси расходуется в первые 5 - 10 мин. [31]
На рис. 24 приведены кинетические кривые, характеризующие накопление продуктов реакции, образующихся при окислении 2 4-дихлортолуола в указанных выше условиях. [33]
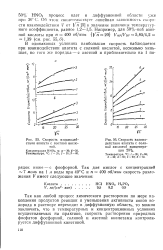 |
Скорость взаимодействия апатита с азотной кислотой.| Скорость взаимо. [34] |
Так как любой процесс химического растворения по мере накопления продуктов реакции и уменьшения активности ионов водорода в растворе переходит в диффузионную область, то можно заключить, что в температурных и концентрационных условиях осуществляемых на практике, скорость растворения природных фосфатов фосфорной, соляной и азотной кислотами контролируется диффузионной кинетикой. [35]
Иногда эту задачу можно решить, сопоставляя скорости накопления продуктов реакции. [36]
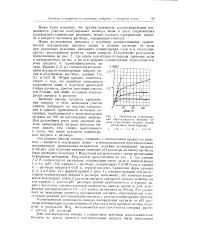 |
Зависимости концентрации образующегося нитрита от дозы в растворах нитрата калия различных концентраций. [37] |
Это падение выхода связано, очевидно, с накоплением продуктов реакции - нитрита и водородных ионов - и возникновением противоположно направленной радиационно-хнмической реакции превращения нитрита в нитрат. Для изучения влияния значения рП раствора на выход процесса было проведено облучение 1 М раствора нитрата калия с тремя различными буферными добавками. Сравнение форм кривых 1, 2, 3 и 4 ( рис. 2) с формой кривой 1 ( рис. 1), соответствующей той же исходной концентрации нитрата в растворе, показывает, что значение активности водородных ионов в растворе нитрата оказывает сильное влияние па ход кривых. Это указывает на замедление процесса превращения нитрита, образующегося в результате реакции восстановления нитрата с ростом концентрации щелочи. [38]
В некоторых случаях эту задачу можно решить сопоставляя скорости накопления продуктов реакции. [39]
Обычно экспериментальное исследование химических реакций сводится к получению функции накопления продуктов реакции во времени с целью определения ( путем обработки найденной функции) значений константы скорости реакции или ее обратной величины, а также температурной зависимости этих величин. [40]
Активность катализатора может меняться в процессе реакции в результате накопления продуктов реакции на поверхности или в порах катализатора или благодаря аккумуляции ядов. [41]
Такой ход скорости реакции ( как и ход кривой накопления продукта реакции) сам по себе служит признаком сложной реакции, так как простая реакция, подчиняющаяся закону действующих масс, имеет максимальную скорость в начальный момент времени, когда концентрация реагирующих веществ имеет максимальное значение. [42]
Топливный элемент с кислым электролитом может работать длительное время без накопления продуктов реакции. Однако анодное окисление метанола и катодное восстановление кислорода в кислых электролитах протекают значительно медленнее, чем в щелочных. Кроме того, ТЗ с кислым электролитом требует использования кислотостойких и коррозионностойких материалов. Поэтому большинство исследователей разрабатывают ТЭ со щелочным электролитом. [43]
В некоторых случаях эту задачу можно решить, сопоставляя скорости накопления продуктов реакции. [44]
Данная реакция катализируется Н, а поэтому скорость ее увеличивается с накоплением продуктов реакции. [45]
Страницы: 1 2 3 4