Наличие - свободная валентность
Cтраница 3
Большую роль в цепных химических реакциях играют свободные атомы и радикалы. Благодаря наличию свободных валентностей эти активные центры реакции легко вступают в реакции с насыщенными молекулами, причем в результате этого взаимодействия всегда возникают новые радикалы. Периодическая регенерация свободных радикалов или атомов в ходе реакции и приводит к цепному механизму процесса. Несмотря на то, что процесс образования свободного атома или радикала требует большой затраты энергии, легкость взаимодействия свободных радикалов с насыщенными молекулами и регенерация при этом новых свободных радикалов приводит к тому, что скорость цепного процесса может быть больше скорости простого нецепного процесса. [31]
Большую роль в цепных химических реакциях играют свободные атомы и радикалы. Благодаря наличию свободных валентностей эти активные центры реакции легко вступают в реакции с насыщенными молекулами, причем в результате этого взаимодействия всегда возникают новые радикалы. Периодическая регенерация свободных радикалов или атомов в ходе реакции и приводит к цепному механизму процесса. [32]
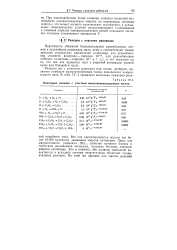
 |
Некоторые реакции с участием валентно-ненасыщенных частиц. [33] |
Лишь для малоактивного радикала НО2 -, свойства которого близки к свойствам насыщенной молекулы, получено большее значение энергии активации. Это и понятно, ибо наличие свободной валентности в исходной системе энергетически облегчает осуществление реакции. По этой же причине для многих реакций с участием радикалов наблюдается линейная связь между энергией активации и теплотой реакции. [34]
Заметим еще, что, по-видимому, неслучайно тримолекулярные реакции обычно идут с участием радикалов. Молекула NO, имеющая неспаренный электрон, может рассматриваться как радикал. Наличие свободной валентности приводит ( в результате взаимодействия во время столкновения) к увеличению времени жизни сталкивающихся пар и, следовательно, к увеличению числа тройных столкновений. Последнее обстоятельство увеличивает вероятность образования тримолекулярных комплексов. [35]
 |
Схема электронных уровней полупроводника. [36] |
По схеме 1.11 6 молекула, обладавшая в свободном состоянии двойной связью, в адсорбированном виде приобретает свободную валентность и делается реакционноспособным поверхностным радикалом. В обоих случаях свободная валентность остается ненасыщенной и после акта адсорбции, но перемещается от атома поверхности катализатора к молекуле, участвующей в реакции. Наличие свободной валентности на поверхности является, с точки зрения электронной теории, необходимым, хотя и не всегда достаточным условием протекания реакции в адсорбционном слое. [37]
 |
Некоторые реакции с участием валентноненасыщенных частиц. [38] |
Все они характеризуются малым ( не более 10000 кал / моль) значением энергии активации. Лишь для малоактивного радикала НО2, свойства которого близки к свойствам насыщенной молекулы, получено большее значение энергии активации. Это и понятно, ибо наличие свободной валентности в исходной системе энергетически облегчает осуще - етвление реакции. [39]
Первое положение - это то, что реакционная способность атомов и радикалов значительно выше, чем валентнонасыщен-ных молекул, вступлению которых в реакцию должно предшествовать такое ослабление связей, которое сравнимо по энергии с их разрывом. Тогда как энергия активации реакций валентно-насыщенных молекул лежит в интервале 50 - 100 ккал, энергия активации реакций радикалов с молекулами составляет всего несколько килокалорий, реже 10 - 20 ккал. Радикал или атом, вследствие наличия свободной валентности, действует своей химической силой на электроны, обеспечивающие связи в молекуле, с которой он встречается. [40]
Согласно этой теории, зарождение цепей происходит на стенках реакционного сосуда путем необратимого распада молекул алкана на радикалы с выбросом последних в объем, где развиваются цепи. Эти необратимые химические реакции алкана с поверхностью обусловлены наличием свободных валентностей на некаталитических стенках, подобных кварцевой поверхности. В результате этого химического взаимодействия алкана со свежей поверхностью в начальной стадии возникает в зоне крекинга концентрация свободных радикалов, превышающая равновесную. Это определяет более высокую скорость в начале крекинга. Начальная стадия крекинга протекает как неравновесная, при этом некаталитическая поверхность выступает на положении инициатора цепного распада. Однако по мере протекания реакции свободные валентности поверхности закрываются и стенки утрачивают свою химическую активность. Вследствие этого концентрация радикалов уменьшается довольно быстро до квазистационарной, а скорость крекинга резко падает и затем изменяется по закону реакций первого порядка. [41]
Нерешенным остается также важный вопрос, каким образом заканчиваются молекулы. В приведенной схеме этот вострое умышленно обойден. Можно предполагать, что молекула растет до бесконечности в соответствии с наличием свободных валентностей, но возможно также, что диглицерид этери-фицирует кислотную группу молекулы фталевой кислоты, ограничивая в этом месте рост макромолекулы. [42]
В то же время катион-радикалы тетраметил-п-бензохинона в основном я-электронном состоянии не вступают в такую реакцию. В реакции дегидрирования спиртов неактивны также катион-радикалы оксипроизводных 1 4-нафтахинона и п-диметилбензальдегида, которые образуются при ионизации в основном я-состоянии. Таким образом, активность катион-радикалов спиртов, альдегидов, кето-нов в реакциях переноса атомов водорода определяется наличием свободной валентности на гетероатоме. [43]
Через 13 лет после создания Вант-Гоффом стереохимической теории Аншютц в упоминавшейся уже обзорной статье писал, что объяснение изомерии фумаровой и малеиновой кислот, данное Вант-Гоффом, переводит решение проблемы в область, едва ли доступную экспериментальному исследованию. Кроме того, Аншютц считал мало вероятным, что незначительное различие в пространственном положении карбоксильных групп может вызвать столь далеко идущее различие в свойствах. С другой стороны, опытные данные ( например, одинаковая скорость присоединения брома к эфирам фумаровой и малеиновой кислоты) опровергали представление Кекуле - Фиттига о наличии свободных валентностей в одной из кислот; да и образование винных кислот при окислении свидетельствовало в пользу существования группировки СНСН в фумаровой и малеиновой кислотах. [44]
 |
Экспериментальные и рассчитанные по теории активированного комплекса константы скорости окисления. [45] |
Страницы: 1 2 3 4